ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.12.2023
Просмотров: 301
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
O(г) + 2H2O(г). (1.57)
По данным приложения 1 найдем стандартные энтальпии образования продуктов и реагентов реакции и их значения поставим в уравнение (1.56) (отметим также, что стехиометрические коэффициенты показывают числа молей реагентов и продуктов в сбалансированном уравнении реакции):
 (NН4NO3(ĸ)) = – 365,4 кДж/моль,
(NН4NO3(ĸ)) = – 365,4 кДж/моль,
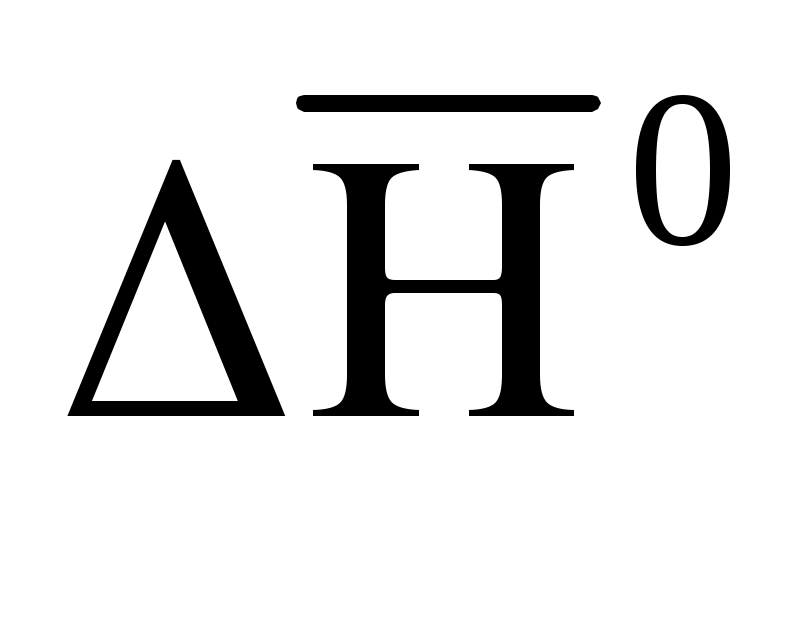 (N2O(г)) = 82,0 кДж/моль,
(N2O(г)) = 82,0 кДж/моль,
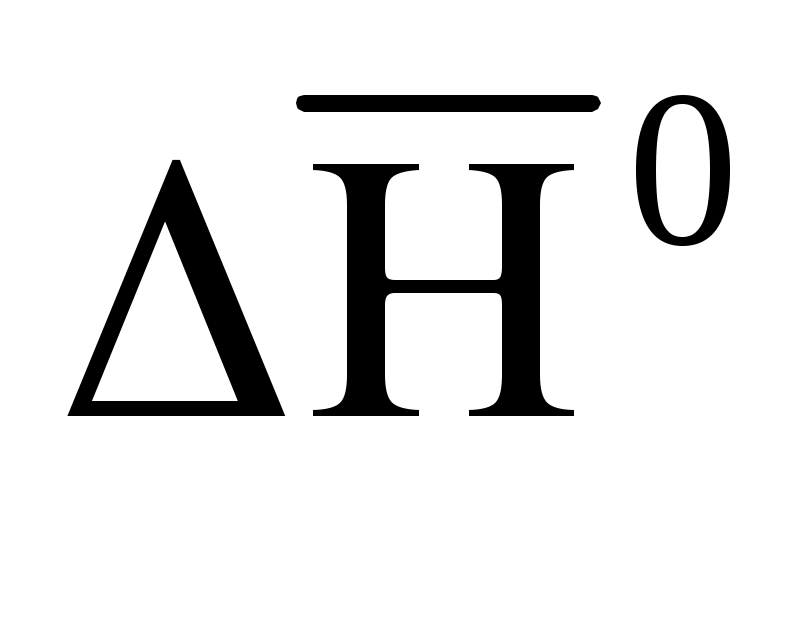 (Н2O(г)) = – 241,8 кДж/моль,
(Н2O(г)) = – 241,8 кДж/моль,
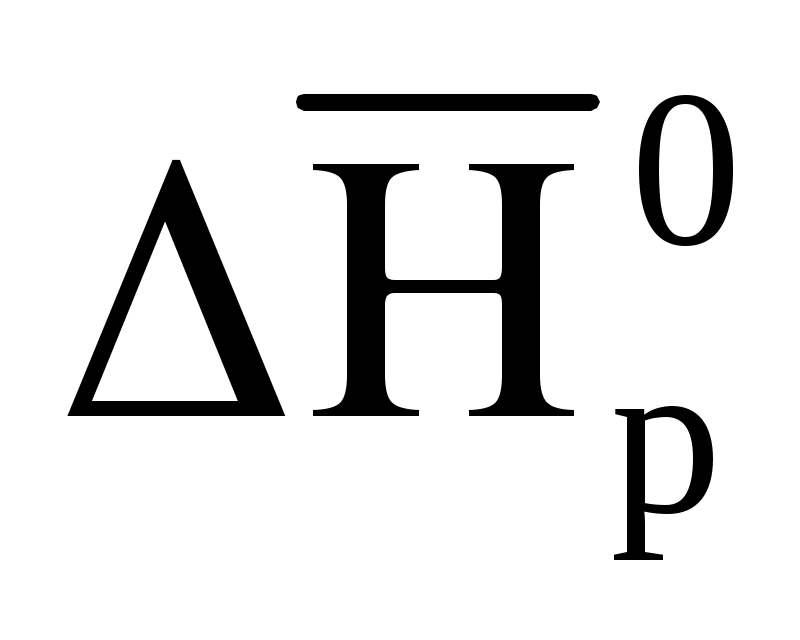 = 2 моль ·
= 2 моль ·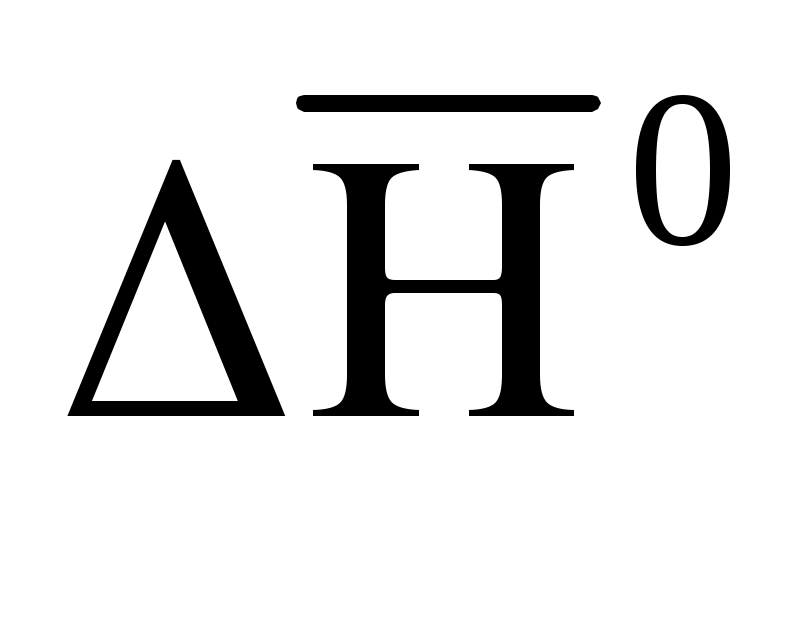 (Н2O(г)) + 1 моль ·
(Н2O(г)) + 1 моль · 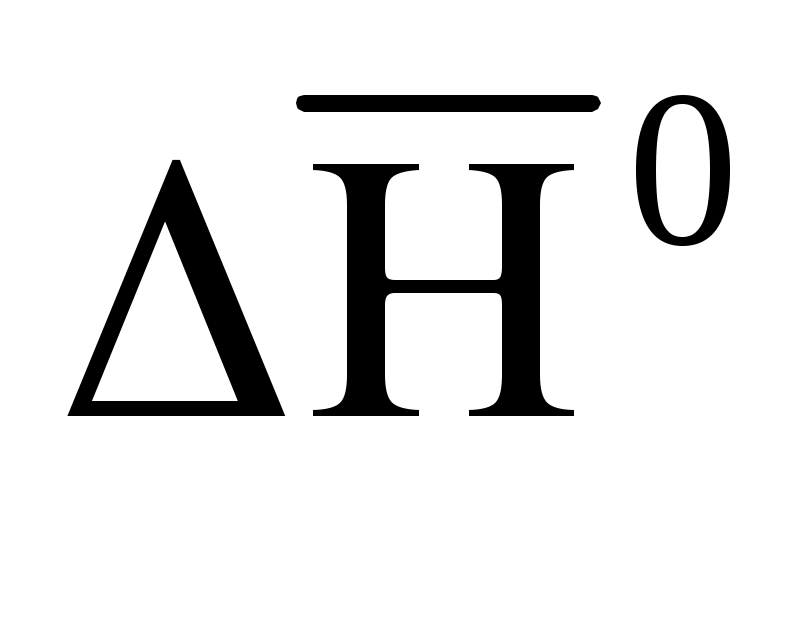 (N2O(г)) –
(N2O(г)) –
– 1 моль · = 2 моль · (– 241,8 кДж/моль)+
= 2 моль · (– 241,8 кДж/моль)+
+1 моль · (82,0 кДж/моль) – 1 моль · (– 365,4 кДж/моль) =
= – 36,2 кДж. (1.58)
Видно, что реакция (1.57) является экзотермической.
Если реакцию образования какого-либо соединения из элементарных веществ осуществить трудно, то для расчета энтальпии его образования можно воспользоваться значениями ряда других реакций, из которых можно составить интересующую нас
ряда других реакций, из которых можно составить интересующую нас
реакцию. Например, можно рассчитать энтальпию образования серной кислоты Н2SO4 (ж), используя изменение энтальпии в реакциях сгорания серы до SO2 и окисления SO2 до SO3 , a также теплоту растворения
SO3 в Н2О(ж) с образованием H2SO4(ж) при 298 К. Искомая
реакция будет суммой реакций, приведенных ниже, а сумма
изменений энтальпий в этих реакциях и есть энтальпия
образования H2SO4(ж):
S (тв) + О2(г)=SO2(г);
= – 296,89 кДж;
S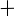 02(г) + ½О2 (г)=SO3(г);
02(г) + ½О2 (г)=SO3(г);  = – 98,28 кДж ;
= – 98,28 кДж ;
S 03(г) + Н2О (ж) = Н2SО4 (ж);
03(г) + Н2О (ж) = Н2SО4 (ж);  = – 130,29 кДж;
= – 130,29 кДж;
Н2(г) + ½ О2 (г) = Н2О (ж); = – 285,85 кДж;
= – 285,85 кДж;
S (тв) + 2 О2 (г) + H2(г) = H2SO4(ж); = – 811,32 кДж .
= – 811,32 кДж .
Здесь изменения стандартных энтальпий суммируемых реакций вычислялось по (1.56).
Для того, чтобы сравнивать тепловые эффекты одноименных фазовых переходов различных веществ, их относят к одному молю веществ при температурах фазовых переходов и давлении, равном 1 атм, и называют стандартными энтальпиями. Так, стандартной энтальпией плавления называется изменение энтальпии, которым сопровождается плавление одного моля вещества при давлении 1 атм и температуре плавления данного вещества. Стандартной энтальпией парообразования
называется изменение энтальпии, которым сопровождается плавление одного моля вещества при давлении 1 атм и температуре плавления данного вещества. Стандартной энтальпией парообразования  называется изменение энтальпии, которым сопровождается переход одного моля вещества из жидкого в газообразное состояние при давлении 1атм и температуре кипения данного вещества.
называется изменение энтальпии, которым сопровождается переход одного моля вещества из жидкого в газообразное состояние при давлении 1атм и температуре кипения данного вещества.
 Указанные фазовые переходы протекают с поглощением энергии, поэтому величины их стандартных энтальпий положительны: ∆Нºпл > 0 и
Указанные фазовые переходы протекают с поглощением энергии, поэтому величины их стандартных энтальпий положительны: ∆Нºпл > 0 и 
> 0. Обратные процессы: по отношению к плавлению – кристаллизация, - к парообразованию – конденсация, протекают при тех же условиях (давлении и температуре), что и прямые процессы, но с выделением теплоты. Поэтому значения их стандартных энтальпий отрицательны: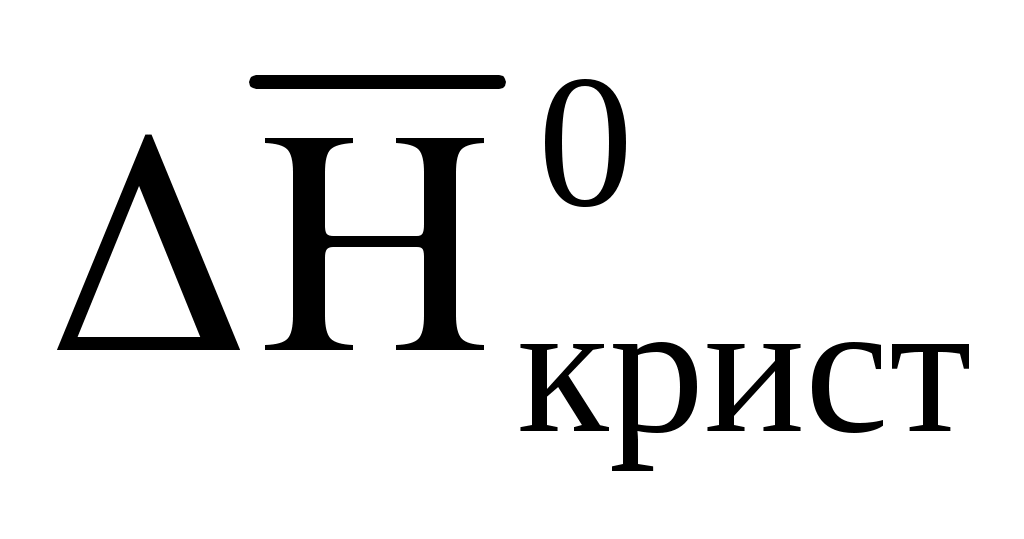 < 0 и
< 0 и  < 0. Абсолютные значения стандартных энтальпий прямых и обратных процессов одних и тех же веществ одинаковы. Поэтому в таблице 1.2 в качестве примера приведены только значения энтальпий плавления и парообразования и температуры фазовых переходов некоторых веществ.
< 0. Абсолютные значения стандартных энтальпий прямых и обратных процессов одних и тех же веществ одинаковы. Поэтому в таблице 1.2 в качестве примера приведены только значения энтальпий плавления и парообразования и температуры фазовых переходов некоторых веществ.
Таблица 1.2
Стандартные энтальпии
плавления и парообразования
СО2(г) = С(граф) + О2(г) . (1.59)
Так как по (1.55) (СО2(г))= – 393,5 кДж/моль, то по (1.56) вычислим ∆Hºр (1.59):
(СО2(г))= – 393,5 кДж/моль, то по (1.56) вычислим ∆Hºр (1.59):
∆Hºр = О + О – 1 моль · (СО2(г)) = 393,5 кДж.
(СО2(г)) = 393,5 кДж.
 , (1.60)
, (1.60)
где стрелки указывают направления прямой (→) и обратной реакций (←). Второй закон термохимии или закон Гесса имеет следующую формулировку: суммарный тепловой эффект химической реакции при постоянном давлении не зависит от ее промежуточных стадий. Этот закон можно сформулировать короче: энтальпийный эффект реакции не зависит от промежуточных стадий. Автор закона Г. И. Гесс, немец по происхождению, работавший профессором Петербургского горного института и установивший этот закон в 1840 г.
Закон Гесса применяется в тех случаях, когда химические превращения могут быть осуществлены несколькими различными путями. При этом результирующее изменение энтальпии одинаково для любого пути. Например, сгорание графита до оксида углерода IV может быть осуществлено двумя путями (а) и (б). Первый путь – это реакция (а) в одну стадию, а второй путь – это процесс в две стадии (б
1) и (б2):
(а) C(граф) + O2(г)=СО2(г); ∆Hºр (а),
второй путь -
(б1) C(граф) + 0,5O2(г) = СО(г); ∆Hºр(б1),
(б2) СО(г) + 0,5О2(г) = СО2(г); ∆Hºр(б2). (1.61)
Из трех реакций (1.61) экспериментально можно определить изменение энтальпии только в двух – в (а) и (б2). В третьей реакции (б1) невозможно определить ∆Hºр, потому что при ее протекании одновременно образуются два продукта – СО и СО2. Разделение полученных газов позволяет затем осуществить реакцию (б2). Затем, используя закон Гесса (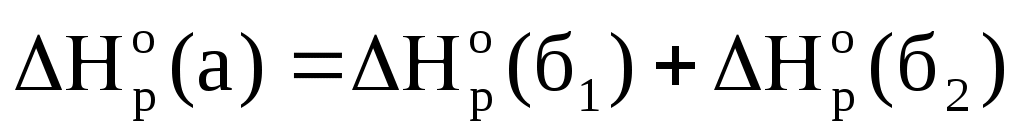 ), можно вычислить изменение энтальпии в реакции б1.
), можно вычислить изменение энтальпии в реакции б1.
Закон Гесса позволяет производить алгебраические действия (сложения, вычитания, умножения и деления на численные множители) с уравнениями реакций, если в них включены тепловые эффекты. Так, если бы нам были известны тепловые эффекты стадий (б1) и (б2) второго пути реакции (1.61), то мы могли бы вычислить тепловой эффект этой реакции, протекающей в одну стадию по пути (а), не осуществляя этот процесс экспериментально. Для этого надо сложить термохимические уравнения реакций (б1) и (б2):
C (граф) + 0,5O2(г) = СО(г) + 110,5 кДж,
(граф) + 0,5O2(г) = СО(г) + 110,5 кДж,
СО(г) + 0,5О2(г) = СО2(г) + 283 кДж,
C(граф) + 0,5O2(г) + СО(г) + 0,5О2(г) = СО(г) + СО2(г) +
+(110,5 +283) кДж.
После сокращения одинаковых членов, подчеркнутых двумя черточками, и сложения одинаковых членов, подчеркнутых одной черточкой, суммарного уравнения получим термохимическое уравнение одностадийной реакции:
C(граф) + O2(г) = СО2(г) + 393,5 кДж.
Рассмотренное применение закона Гесса к двум путям получения оксида углерода IV может быть представлено в виде энтальпийной диаграммы (рис. 1.9), по которой видно, что ∆Hºр(а) = ∆Hºр(б1) + ∆Hºр(б2).
Верхний уровень диаграммы называется исходным уровнем. Он соответствует энтальпиям образования элементарных веществ в их стандартных состояниях (
По данным приложения 1 найдем стандартные энтальпии образования продуктов и реагентов реакции и их значения поставим в уравнение (1.56) (отметим также, что стехиометрические коэффициенты показывают числа молей реагентов и продуктов в сбалансированном уравнении реакции):
– 1 моль ·
+1 моль · (82,0 кДж/моль) – 1 моль · (– 365,4 кДж/моль) =
= – 36,2 кДж. (1.58)
Видно, что реакция (1.57) является экзотермической.
Если реакцию образования какого-либо соединения из элементарных веществ осуществить трудно, то для расчета энтальпии его образования можно воспользоваться значениями
реакцию. Например, можно рассчитать энтальпию образования серной кислоты Н2SO4 (ж), используя изменение энтальпии в реакциях сгорания серы до SO2 и окисления SO2 до SO3 , a также теплоту растворения
SO3 в Н2О(ж) с образованием H2SO4(ж) при 298 К. Искомая
реакция будет суммой реакций, приведенных ниже, а сумма
изменений энтальпий в этих реакциях и есть энтальпия
образования H2SO4(ж):
S (тв) + О2(г)=SO2(г);
= – 296,89 кДж;
S
 02(г) + ½О2 (г)=SO3(г);
02(г) + ½О2 (г)=SO3(г); S
 03(г) + Н2О (ж) = Н2SО4 (ж);
03(г) + Н2О (ж) = Н2SО4 (ж); Н2(г) + ½ О2 (г) = Н2О (ж);
S (тв) + 2 О2 (г) + H2(г) = H2SO4(ж);
Здесь изменения стандартных энтальпий суммируемых реакций вычислялось по (1.56).
Для того, чтобы сравнивать тепловые эффекты одноименных фазовых переходов различных веществ, их относят к одному молю веществ при температурах фазовых переходов и давлении, равном 1 атм, и называют стандартными энтальпиями. Так, стандартной энтальпией плавления
 Указанные фазовые переходы протекают с поглощением энергии, поэтому величины их стандартных энтальпий положительны: ∆Нºпл > 0 и
Указанные фазовые переходы протекают с поглощением энергии, поэтому величины их стандартных энтальпий положительны: ∆Нºпл > 0 и > 0. Обратные процессы: по отношению к плавлению – кристаллизация, - к парообразованию – конденсация, протекают при тех же условиях (давлении и температуре), что и прямые процессы, но с выделением теплоты. Поэтому значения их стандартных энтальпий отрицательны:
Таблица 1.2
Стандартные энтальпии
плавления и парообразования
| Вещество | Тпл, К | _ ∆Hºпл, кДж/моль | Тп.о., К | _ ∆Hºп.о., кДж/моль |
| HCl | 159 | 1,99 | 189,1 | 14,8 |
| H2O | 273,15 | 6,01 | 373,15 | 40,6 |
| NH3 | 195,5 | 5,65 | 239,0 | 23,3 |
| CH4 | 90,7 | 0,94 | 111,7 | 8,2 |
| CCl4 | 250,2 | 2,51 | 349,8 | 30,0 |
| C6H6 | 278,6 | 9,83 | 353,23 | 30,8 |
1.2.3. Применение первого закона термодинамики к термохимии
Оксид углерода IV, полученный по реакции (1.53), можно разложить на элементарные вещества: графит и кислород – в соответствии с первым законом термохимии, который называют также законом Лавуазье и Лапласа. Если при образовании какого-либо химического соединения из элементарных веществ выделяется определенное количество теплоты, то такое же количество теплоты требуется затратить на разложение этого химического соединения на элементарные вещества. Авторы этого закона французские ученые А. Лавуазье и П. Лаплас (1870 г.).
СО2(г) = С(граф) + О2(г) . (1.59)
Так как по (1.55)
∆Hºр = О + О – 1 моль ·
Положительное значение ∆Hºр указывает на то, что реакция (1.59) эндотермическая, а величина ∆Hºр соответствует выводу первого закона термохимии (∆Hºр (1.59) = – ∆Hºр(1.53)). В общем виде выполняется:
где стрелки указывают направления прямой (→) и обратной реакций (←). Второй закон термохимии или закон Гесса имеет следующую формулировку: суммарный тепловой эффект химической реакции при постоянном давлении не зависит от ее промежуточных стадий. Этот закон можно сформулировать короче: энтальпийный эффект реакции не зависит от промежуточных стадий. Автор закона Г. И. Гесс, немец по происхождению, работавший профессором Петербургского горного института и установивший этот закон в 1840 г.
Закон Гесса применяется в тех случаях, когда химические превращения могут быть осуществлены несколькими различными путями. При этом результирующее изменение энтальпии одинаково для любого пути. Например, сгорание графита до оксида углерода IV может быть осуществлено двумя путями (а) и (б). Первый путь – это реакция (а) в одну стадию, а второй путь – это процесс в две стадии (б
1) и (б2):
первый путь -
(а) C(граф) + O2(г)=СО2(г); ∆Hºр (а),
второй путь -
(б1) C(граф) + 0,5O2(г) = СО(г); ∆Hºр(б1),
(б2) СО(г) + 0,5О2(г) = СО2(г); ∆Hºр(б2). (1.61)
Из трех реакций (1.61) экспериментально можно определить изменение энтальпии только в двух – в (а) и (б2). В третьей реакции (б1) невозможно определить ∆Hºр, потому что при ее протекании одновременно образуются два продукта – СО и СО2. Разделение полученных газов позволяет затем осуществить реакцию (б2). Затем, используя закон Гесса (
Закон Гесса позволяет производить алгебраические действия (сложения, вычитания, умножения и деления на численные множители) с уравнениями реакций, если в них включены тепловые эффекты. Так, если бы нам были известны тепловые эффекты стадий (б1) и (б2) второго пути реакции (1.61), то мы могли бы вычислить тепловой эффект этой реакции, протекающей в одну стадию по пути (а), не осуществляя этот процесс экспериментально. Для этого надо сложить термохимические уравнения реакций (б1) и (б2):
C
 (граф) + 0,5O2(г) = СО(г) + 110,5 кДж,
(граф) + 0,5O2(г) = СО(г) + 110,5 кДж,СО(г) + 0,5О2(г) = СО2(г) + 283 кДж,
C(граф) + 0,5O2(г) + СО(г) + 0,5О2(г) = СО(г) + СО2(г) +
+(110,5 +283) кДж.
После сокращения одинаковых членов, подчеркнутых двумя черточками, и сложения одинаковых членов, подчеркнутых одной черточкой, суммарного уравнения получим термохимическое уравнение одностадийной реакции:
C(граф) + O2(г) = СО2(г) + 393,5 кДж.
Рассмотренное применение закона Гесса к двум путям получения оксида углерода IV может быть представлено в виде энтальпийной диаграммы (рис. 1.9), по которой видно, что ∆Hºр(а) = ∆Hºр(б1) + ∆Hºр(б2).
Верхний уровень диаграммы называется исходным уровнем. Он соответствует энтальпиям образования элементарных веществ в их стандартных состояниях (