ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.12.2023
Просмотров: 292
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
где
Действительно, в соответствии с законом Гесса рассматриваемый процесс может быть проведен двумя путями (а) или (б) по представленной схеме:
Т2=263 К (а) Т2=263 К

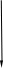
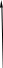
(
 б)
б)(б")
 Н2О(ж) Н2О(к)
Н2О(ж) Н2О(к)Т1=273 К
Видно, что энтальпия процесса (а) равна сумме энтальпий стадий (б'), (б'') и (б'''), т.е. энтальпии процесса (б). При этом стадия (б'') проводится при Т1 (кристаллизация воды при температуре кристаллизации), а стадии (б') и (б''') – это нагревание и охлаждение соответственно жидкой воды и льда, изменения энтальпий в которых легко вычислить по (1.41):
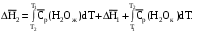
Алгебраически суммируя интегралы, получим:
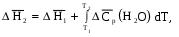
т.е. выражение (1.69). Решим последнее уравнение:
_ _ _ _
ΔН2 = ΔН1 + [Ср(Н2Ок) – Ср(Н2
Ож)] · (Т2 – Т1) =
= – 6009 Дж/моль + [(36,9Дж/(моль·К)) – (75,31 Дж/(моль·К))] ·
· (263К – 273К) = – 5625Дж/моль.
В заключение отметим, что если процессы протекают при постоянном объеме, то их тепловые эффекты необходимо вычислять по формулам, аналогичным (1.67) и (1.69), используя значения ΔU и ΔCV соответственно вместо ΔН и ΔСр.
1.3. ВТОРОЙ И ТРЕТИЙ ЗАКОН ТЕРМОДИНАМИКИ
Первый закон термодинамики утверждает, что при превращении одной формы энергии в другую общее количество энергии сохраняется. На какие-либо ограничения этого процесса первый закон не указывает. Однако известно, что многие процессы характеризуются самопроизвольным или естественным течением, другие процессы самопроизвольно протекать не могут, и как раз с этим связан второй закон термодинамики. Например, газ расширяется в пустоту, но обратный процесс не протекает никогда. Хотя формально это не нарушило бы первый закон. Он не был бы нарушен и в том случае, если бы стержень с первоначально одинаковой температурой по всей длине стал горячим на одном конце и холодным на другом. Но мы знаем, что на практике этого никогда не случится. Второй закон устанавливает критерий, позволяющий предсказать, может ли данный процесс идти самопроизвольно или нет, и поэтому он имеет важное значение для химии.
1.3.1. Обратимые и необратимые, самопроизвольные и
несамопроизвольные процессы
Обратимым называется процесс, который в любой момент времени можно заставить протекать в обратном направлении, изменив какую-нибудь независимую переменную на бесконечно малую величину. Рассмотрим в качестве примера процесс теплообмена между двумя закрытыми системами I и II (рис.1.12). В нем независимой переменной является температура. По схеме рисунка система I представляет собой емкость (1), в которой при температуре 273,15 К находятся в равновесии вода (3) и кусок льда (2) в количествах, равных соответственно а и в. При этой температуре не будет происходить ни плавления льда, ни кристаллизации воды. На молекулярном уровне рассматриваемое состояние равновесное и динамическое, то есть подвижное, - за каждую единицу времени какое-то количество молекул льда переходит в воду (плавится) и такое же количество молекул жидкой воды переходит в лед (кристаллизуется). Подобные состояния систем могут быть записаны в виде уравнений. Например, для системы I при Т = 273,15К будет выполняться следующее уравнение:
1
2
3
4
5
6
4
H2O(к) ⇄ Н2О(ж). (1.70)


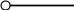
I
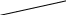
II
Рис. 1.12. Схема теплообмена между закрытыми системами I и II:
1- емкость с водой и льдом; 2- лед; 3 – вода;
4 – тепловая изоляция; 5 – пробное тело;
6 – емкость с теплоносителем
Система II представляет собой тепловой резервуар, теплоносителем которого могут быть различные вещества, включая воду. Пробное тело (5) – это небольшой металлический шарик, укрепленный на ручке, изготовленной из полимерного материала, плохо проводящего теплоту.
Если температура теплоносителя системы II будет незначительно выше 273,15К, то, касаясь пробным телом неизолированных участков вначале системы II, а затем системы I, мы перенесем от системы II системе I порцию теплоты dq. Эту операцию можно повторять многократно. Каждая порция теплоты dq будет увеличивать на бесконечно малую величину температуру воды в емкости (1) на dT, что будет приводить к плавлению бесконечно малой порции льда и образованию из нее такой же бесконечно малой порции воды dn. В последней будет сосредотачиваться (запасаться) теплота dq в виде скрытой теплоты плавления:
Для того чтобы расплавилось заметное количество льда (например, заштрихованная часть куска льда на рис. 1.12) и образовалось такое же количество воды, описанный процесс теплообмена порциями dq необходимо проводить бесконечно долго (назовем его прямым процессом). При этом все количество переданной от системы II системе I теплоты можно вычислить интегрированием бесконечно малых порций dq по (1.71):
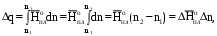 (1.72)
(1.72) где n1 и n2 – соответственно начальное и конечное количества воды в системе I. Это количество теплоты, полученное от системы II в прямом процессе, окажется запасенным в системе I. И если прямой процесс протекал без потерь теплоты в окружающее пространство, то его можно назвать обратимым. Только в обратимом
процессе запасается такое количество теплоты, которого достаточно для протекания обратного процесса и возвращения системы к начальному состоянию. Рассматриваемый прямой процесс можно было в любой момент времени повернуть в обратное направление. Мы это сделаем после завершения прямого процесса.
Допустим, что, понизив предварительно температуру теплоносителя системы II до значения, незначительно ниже 273,15 К, мы пробным телом будем касаться вначале системы I, затем системы II. При этом теплота бесконечно малыми порциями dq будет передаваться от системы I системе II. Если такой обратный процесс проводить бесконечно долго, то часть воды в системе I закристаллизуется и, если количество образовавшегося при этом льда будет равно ∆n, то система I передаст системе II такое же количество теплоты ∆q, как в прямом процессе по (1.72):

где штрихом помечены числа молей льда. Для системы I в обратимом процессе выполнится равенство:
∆q(прям.) = – ∆q(обратн.), (1.73)
а после завершения всего цикла она придет к исходному состоянию с количествами воды и льда соответственно а и в при Т = 273,15К.
Если рассмотренные прямой и обратный процессы проводить с заметной скоростью за какой-то конечный промежуток времени, то теплоту от одной системы к другой системе необходимо передавать большими количествами. При этом будут неизбежны потери теплоты в окружение и не выполнится равенство (1.73):
∆q(прям.) ≠ – ∆q(обратн.). (1.74)
В этом случае процесс будет необратимым.
В качестве примера можно рассмотреть реакцию сгорания пропана (бытового газа) в газовой горелке:
С3Н8(г)+5О2(г) = 3СО2(г)+4Н2О(г); ∆Нºр = – 2202 кДж. (1.75)
В этой реакции выделяется теплота (∆Нºр<0), она экзотермическая и протекает с заметной скоростью. Можно ли повернуть эту реакцию в сторону образования реагентов, изменив температуру реакционной смеси на dТ? Конечно же, это невозможно. Иначе бы мы, поднеся к пламени горелки горячее пробное тело, погасили бы пламя. Эта реакция необратима еще и потому, что протекает с отдачей теплоты окружению.
Итак, обратимые процессы протекают бесконечно медленно и долго, без потерь энергии в окружение. Необратимые процессы протекают с заметной скоростью и с потерями энергии в окружение.
Рассмотрим далее самопроизвольные процессы, то есть процессы, протекающие без воздействия на системы окружения. Давно установлено, что самопроизвольно осуществляются процессы, ведущие к понижению потенциальной энергии систем. Так, камень самопроизвольно скатывается вниз по склону горы и его потенциальная энергия (mgh) при этом понижается. Примером такого же процесса может быть реакция (1.75). В ней энтальпия образования продуктов реакции ∆Hºпрод (потенциальная энергия продуктов) меньше энтальпии образования реагентов ∆Hºреаг (потенциальной энергии реагентов). Уменьшение потенциальной энергии реакционной системы (1.75) равно:
∆Hºр = ∆Hºпрод – ∆Hºреаг = – 2202 кДж.
О реакциях, которые протекают самопроизвольно и с выделением энергии (экзотермические реакции), говорят, что их движущим фактором является энтальпийный фактор (∆Hºр<0)(при V=const, ΔUop<0).
Исходя из опыта, можно утверждать, что самопроизвольные процессы не идут в обратном направлении. Например, камень не закатывается сам на вершину горы. Процессы, обратные по отношению к самопроизвольным, называются несамопроизвольными. Чтобы вызвать несамопроизвольный процесс, к системе необходимо подвести энергию извне. Очевидно, что нужно совершить работу, для того чтобы закатить камень на вершину горы. А к химической системе (1.75) необходимо подвести энергию в соответствии с первым законом термохимии, для того чтобы она прошла в обратном направлении.
Наряду с самопроизвольными экзотермическими процессами известны самопроизвольные эндотермические процессы. Например: плавление льда при стандартных условиях –
_
Н2О (к) → Н2О (ж); ∆Нº = 6,0 кДж/моль ;
растворение хлорида калия в воде –
_
КСl(к) + Вода → КСl(водн); ∆Нº = 19 кДж/моль;
испарение воды –
_
Н2О (ж) → Н2О (г); ∆Нº = 44 кДж/моль.
Все три примера имеют одно общее свойство – частицы исходных состояний более упорядочены, чем частицы конечных состояний. Действительно, регулярная структура льда из молекул воды в узлах кристаллической решетки при плавлении заменяется жидкими ассоциатами молекул воды в среде жидкой воды, не имеющей регулярного строения. Растворение хлорида калия также сопровождается разрушением кристаллической решетки и возникновением беспорядочного распределения ионов К+ и Сl¯ в воде. Когда испаряется вода