Файл: Острый аппендицит. Этиопатогенез, клиника, дифференциальная диагностика.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.10.2023
Просмотров: 644
Скачиваний: 1
СОДЕРЖАНИЕ
Стандарты диагностики и лечения острого холецистита
Причины стриктур жёлчных протоков
Симптомы стриктур жёлчных протоков
Диагностика стриктур жёлчных протоков
Лечение стриктур жёлчных протоков
Симптомы свища желчного пузыря
Лечение паралитической кишечной непроходимости
Выделяют следующие осложнения язвенной болезни.
Осложнения язвенной болезни двенадцатиперстной кишки:
ФАКТОРЫ АГРЕССИВНОГО И ЗАЩИТНОГО ДЕЙСТВИЯ
Выделяют следующие осложнения язвенной болезни.
Осложнения язвенной болезни двенадцатиперстной кишки:
ФАКТОРЫ АГРЕССИВНОГО И ЗАЩИТНОГО ДЕЙСТВИЯ
КЛАССИФИКАЦИЯ ЯЗВЕННОЙ БОЛЕЗНИ
Б) ПО ФАЗЕ ТЕЧЕНИЯ ЯЗВЕННОГО ПРОЦЕССА
КЛАССИФИКАЦИЯ БОЛЕЗНЕЙ ОПЕРИРОВАННОГО ЖЕЛУДКА
Общая характеристика повреждений живота
ОСОБЕННОСТИ ТЕЧЕНИЯ ХИРУРГИЧЕСКОЙ ПАТОЛОГИИ НА ФОНЕ САХАРНОГО ДИАБЕТА
Псевдоперитонит (ложный «острый живот») при сахарном диабете
Заключительный этап хирургического вмешательства — рациональное дренирование брюшной полости (рисунок 1).
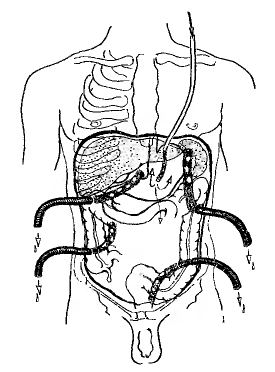
Рисунок 1 – Схема дренирования брюшной полости при разлитом перитоните
Задача по созданию условий для полноценной санации брюшной полости в послеоперационном периоде решается разными путями в зависимости от конкретных условий. Эффективным методом послеоперационной санации брюшной полости является орошение её раствором антисептиков (широко применявшиеся ранее растворы с антибиотиками, как показали метаисследования, не имеют никаких преимуществ перед обычными антисептиками, но в то же время способствуют развитию антибиотикорезистентности!). С этой целью через проколы в правом и левом подреберьях в поперечном направлении вводится дренажная трубка диаметром 3–4 мм с множественными перфорационными отверстиями на протяжении той её части, которая находится в брюшной полости. Оба выведенных конца трубки служат для капельного (лучше) или фракционного (хуже) введения в брюшную полость раствора. При необходимости ниже уровня первой трубки отступя 10–15 см вводится аналогичным образом другая.
С целью удаления скопившейся жидкости в полость малого таза через разрез в паховой области слева или справа вводится дренажная двухпросветная трубка, обеспечивающая возможность активной аспирации с введением промывной жидкости через ниппельный канал. Больного укладывают горизонтально и приподнимают головной конец кровати. При необходимости дополнительного дренирования боковых каналов брюшины оно осуществляется также двухпросветными трубками через дополнительные проколы брюшной стенки. Попытки осуществления послеоперационной санации брюшной полости через несколько ниппельных дренажей, введенных в различные отделы между кишечными петлями или в боковые каналы брюшины, оказались малоэффективными. Через несколько часов вокруг таких микродренажей образуются небольшие замкнутые полости, которыми и ограничивается контакт растворов с брюшиной.
Завершается первичная операция при распространенном перитоните и полноценно выполненной санации брюшной полости ушиванием раны брюшной стенки. При наличии выраженного кишечного пареза или выраженных признаков воспаления висцеральной и париетальной брюшины осуществляется ушивание только кожи с подкожной клетчаткой. Это, вопервых, предотвращает вредные последствия повышения внутрибрюшного давления в первые дни после операции, а вовторых, обеспечивает возможность выполнения повторной программируемой санации брюшной полости через сутки–двое в случае неудовлетворенности хирурга санирующими мероприятиями в ходе первой операции. Иногда с этой целью на брюшную стенку накладывают провизорные швы или фиксируют на ней замыкающее устройство с «молнией», что не совсем точно обозначается как наложение «лапаростомы».
Истинная лапаростома, когда брюшная стенка не ушивается, а кишечные петли покрываются мазевыми тампонами, или когда лечение открытой брюшной раны осуществляется в камерах с абактериальной средой, может применяться лишь в исключительных случаях (при наличии множественных несформированных кишечных свищей, анаэробном перитоните или флегмоне брюшной стенки).
Когда же подобные ситуации развиваются вторично в результате повторных эвентраций, приводящих к образованию раны брюшной стенки с фиксированными краями, дно которой составляют кишечные петли, они должны быть изолированы от прямого контакта с внешней средой. С этой целью после кратковременной подготовки санирующими повязками с водорастворимыми мазями кишечные петли укрывают расщепленным перфорированным (дермотомным) свободным лоскутом аутокожи. Ущерб от образовавшейся вследствие такой методики ложной вентральной грыжи брюшной стенки «компенсируется» предовращением гибели больного от распространенного перитонита или от образования множественных тонкокишечных свищей.
В последние годы в связи с развитием эндовидеохирургических технологий появилась возможность осуществления с их помощью запрограммированной или возникающей по показаниям повторной санации брюшной полости после операции по поводу распространенного перитонита, не прибегая к релапаротомии. Имеющиеся для этого специальные элеваторы позволяют избежать необходимости массированной инсуфляции газа в брюшную полость и успешно производить ревизию и санацию различных отделов брюшной полости.
Обеспечение полноценного питания
в катаболической фазе послеоперационного периода предусматривает внедрение наряду с современными технологиями парентерального питания методов раннего энтерального питания с помощью специальных питательных составов и одновременного введения пищеварительных ферментов. При невозможности зондового питания (расположение источника перитонита в верхнем этаже брюшном полости) для этих целей может использоваться наложение энтеростомы в начальных отделах тощей кишки (также возможно с помощью эндовидеохирургической техники).
Большое значение в послеоперационном периоде придают мероприятиям по коррекции нарушенного иммунитета.
Адекватное обезболивание.
Наряду с традиционными способами лечения болевого синдрома с помощью наркотических и ненаркотических анальгетиков, применяется пролонгированная эпидуральная аналгезия местными анестетиками, иглорефлексоаналгезия, электроанальгезия.
Одно из центральных мест в комплексном лечении перитонита и эндогенной интоксикации в послеоперационном периоде занимает детоксикационная терапия. Современные методы детоксикации разделяются на две группы: интракорпоральные и экстракорпоральные.
К интракорпоральным относятся: энтеральная детоксикация, гемодилюция, форсированный диурез, перитонеальный диализ, энтеросорбция, непрямое электрохимическое окисление крови. К экстракорпоральным методам детоксикации относятся: гемодиализ, гемофильтрация, плазмаферез, гемосорбция, плазмосорбция, лимфосорбция, квантовая терапия крови, ксеноспленоперфузия.
СИНДРОМ ИНТРААБДОМИНАЛЬНОЙ ГИПЕРТЕНЗИИ
Синдром интраабдоминальной гипертензии (СИАГ) (Abdominal Compartment Syndrome) был впервые описан Kron et al в 1984 г. как вероятное осложнение после операций по поводу разрыва аневризмы брюшного отдела аорты. В последующий период этому осложнению было посвящено большое количество исследований, и в настоящее время стало возможным полагать, что частота СИАГ в послеоперационном периоде (после операций на органах брюшной полости) достигает 15–20 %, но критические формы с развитием синдрома полиорганной недостаточности встречаются значительно реже.
Подъем интраабдоминального давления, развивающийся после закрытия брюшной полости у больных, оперированных по поводу разлитого перитонита, способен привести к развитию синдрома, схожего по клинической картине с синдромом полиорганной недостаточности.
Следует отметить, что если типичная ПОН у больных с сепсисом, развивается в результате индукции воспалительного каскада микроорганизмами или продуктами их жизнедеятельности с последующим нарушением микроциркуляции в дистантных органах, то повышение внутрибрюшного давления само вызывает нарушение микроциркуляции в спланхническом бассейне.
Нарушения микроциркуляции в виде сладжа и повышения проницаемости сосудистой стенки являются ведущим звеном патогенеза СИАГ.
К группе риска развития СИАГ относятся больные с развившимся повышением объема внутренних органов в полости брюшины. Среди них больные с тяжелым распространенным перитонитом, требующие в послеоперационном периоде больших объемов инфузионной терапии. К этой группе относятся и пациенты с кишечной непроходимостью, у которых не проводилось дренирование тонкой кишки.
Клиническим проявлениеми СИАГ служит быстрое развитие почечной недостаточности (в виде олигурии) и прогрессирующей дыхательной недостаточности. Генез олигурии при СИАГ — реноваскулярная компрессия, поэтому характерным клиническим признаком олигурии при СИАГ является ее резистентность к инфузионной терапии и стимуляции. Повышение давления в воздухоносных путях при проведении искусственной вентиляции легких, требующее повышение давления в контуре аппарата для того, чтобы обеспечить необходимый дыхательный объем, наряду с резистентной олигурией являются ранними и достоверными признаками СИАГ.
Наиболее доступным и клинически эффективным диагностическим приемом, позволяющим выявить нарастающее внутрибрюшное давление, служит катетеризация мочевого пузыря (после наполнения его 70–100 мл физиологического раствора) и определение внутрипузырного давления. При этом давление более 3035 мм рт.ст. является потенциально опасным.
Лечение СИАГ только хирургическое. В 93 % выполненная лапаротомия и высвобождение внутренних органов с формированием временной лапаростомы приводит к быстрому регрессу развивающейся ПОН. Средние сроки существования лапаростомы в этой ситуации — 2–4 суток.
ПРИНЦИПЫ АНТИБАКТЕРИАЛЬНОЙ ТЕРАПИИ ПРИ ПЕРИТОНИТЕ
После адекватной хирургической санации очага перитонита, рациональное использование антибиотиков в комплексном лечении абдоминального сепсиса выходит по значимости на первое место. Выбор схемы антибактериальной терапии определяет несколько важных факторов. Первый и один из самых важных — тип перитонита, под которым понимается первичный, вторичный, третичный (таблица 2). Каждый из них характеризуется своим набором микроорганизмов, знание которых позволяет спланировать грамотную эмпирическую терапию. После получения результатов микробиологического исследования проводится корректировка схем антибактериальной терапии, однако только в тех случаях, когда она неэффективна.
Пути введения антимикробных препаратов:
1) местный (внутрибрюшной) – через ирригаторы и дренажи;
2) общий:
а) Внутривенный;
б) Внутриартериальный (внутриаортальный, в чревный ствол, в брыжеечные или сальниковую артерии);
в) Внутримышечный (только после восстановлении микроциркуляции);
г) Внутрипортальный – через реканализированную пупочную вену в круглой связке печени;
д) Эндолимфатический:
Антероградный – через микрохирургически катетеризированный периферический лимфатический сосуд на тыле стопы или депульпированный паховый лимфатический узел.
Ретроградный через грудной лимфатический проток.
Лимфотропный внутритканевой – через лимфатическую сеть голени, забрюшинного пространства.
Таблица 2 – Основные возбудители перитонита и используемые антибактериальные препараты (И.А. Ерюхин, С.А Шляпников, 2005)
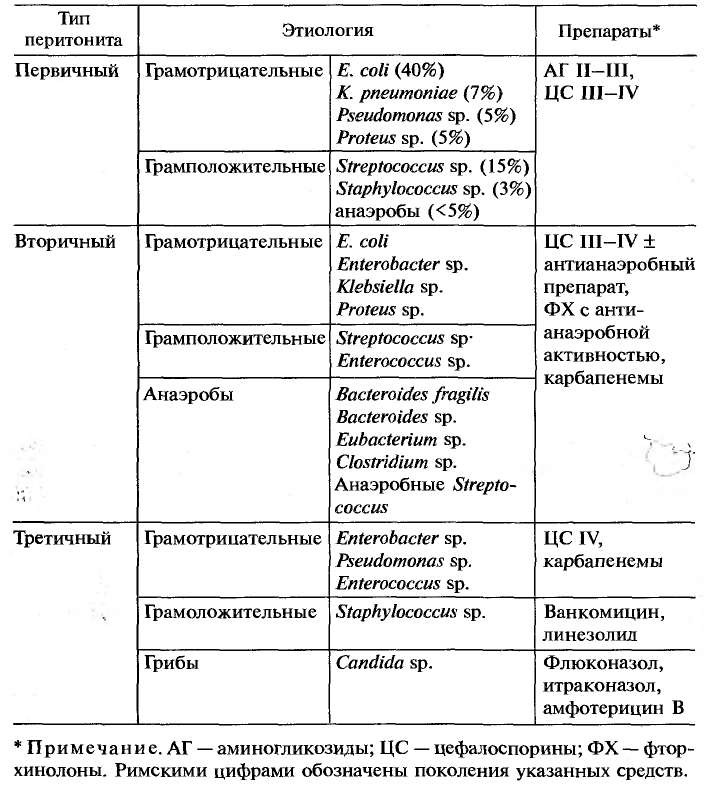
Первичный перитонит составляет примерно 1 % от всех клинических случаев перитонита. Он развивается у больных, страдающих тяжелыми фоновыми заболеваниями, и основными возбудителями являются пневмококки (Strept. Pneumoniae) и грамотрицательные палочки (Esherichiacoli, Klebsiellaspp.). Как правило, среди возбудителей отсутствуют анаэробные микроорганизмы, и инфекционный процесс вызывается одним возбудителем. Возбудители попадают гематогенным путем или за счет транслокации через стенку кишечника. Наиболее часто используемые препараты: аминогликозиды (гентамицин, амикацин, нетромицин), цефалоспорины III – IV (цефтриаксон, цефтазидим, цефепим).
Вторичный перитонит, наиболее часто встречающийся в клинической практике, вызывается энтеральными грамотрицательными возбудителями и облигатными анаэробами. На выбор антибиотика существенное влияние оказывают следующие факторы. Вопервых, локализация первичного очага. В зависимости от того, является ли источником верхний отдел желудочнокишечного тракта или нижний, желчевыводящие и мочевыводящие пути, определяется преимущественная микрофлора, вегетирующая в этой зоне. Вовторых, важнейшим фактором является тяжесть состояния больного и степень органной недостаточности. Оценку этих параметров проводят по широко распространенным шкалам: SAPS (наиболее распространена в Европейских странах) или APACHE II (используется в США и Канаде) и SOFA. Общий принцип заключается в том, что чем тяжелее состояние больного, тем более мощные и менее токсичные антибиотики должны применяться (таблица 3).