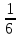Файл: 1. Элементарлы талдау а талданатын заттаы жеке компоненттерді анытайтын сапалы жне санды талдау дістері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 1537
Скачиваний: 1
СОДЕРЖАНИЕ
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
*С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
A) Сұйылтылған азот қышқылымен.
A) Сұйылтылған хлорсутек қышқылы.
A) Калийдің гексанитрокупраты(II).
B) Қорғасынның гексанитрокупраты(II).
C) Натрийдің гексанитрокупраты(II).
*D) Калий және қорғасынның гексанитрокупраты(II).
*A) Қаныққан натрий карбонаты ерітіндісімен өңдеу
A) Концентрлі аммиак ерітіндісі.
B) Қаныққан натрий карбонаты ерітіндісі.
A) Концентрлі аммиак ерітіндісі.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
201. АmBn жүйесі үшін тұнбаның түзілу жағдайы ( ):
A) КS мәні температураға тәуелді емес.
B) Температура жоғарылаған сайын Кsмәні артады.
222. Комплекстүзу реакциясы арқылы ерітіндіге нашар өтетін тұнба:
*A) Оствальдтың сұйылту заңына.
*A) Оствальдтың сұйылту заңына.
D) Тұнбаға түсіру кезіндегі ортаның рН мәнімен.
А) Массаларының қатынасы 1:10.
В) Көлемдерінің қатынасы 1:10.
*Е) Эквивалент мөлшерлерінің қатынасы 1:1.
*C) Индикатормен де, индикаторсыз да.
*A) Жұтылу спектрі - жұтылған жарықтың толқын ұзындығы.
A) Электромагнитті сәулеленудің табиғатын білу үшін.
*A) Жұмысшы электроды потенциалы – титрант көлемі.
*A) Жартылай толқын потенциалдардың айырымын арттыру үшін
B) Оптикалық жұтылу мен жұтылу қабатындағы толқын ұзындығыарасындағы сызықтық байланыс.
C) Оптикалық жұтылу мен жарық жұтылуындағы толқын ұзындығы арасындағы сызықтық байланыс.
D) Молярлық жұтылу мен толқын ұзындығы арасындағы сызықтық байланыс.
A) Тұрақты ток күшіндегі кулонометрия.
*A) Ток күшінің уақытқа көбейтіндісі.
B) Кернеудің уақытқа көбейтіндісі.
*A) Иондық.
B) Сутектік.
C) Металдық.
D) Донорлы-акцепторлы.
E) Молекулалық.
360. Ішкі сферадағы комплекстүзуші мен лиганда арасындағы байланыс:
А) Металдық.
В) Иондық.
С) Полярсыз ковалентті.
D) Сутектік.
*Е) Донорлы-акцепторлық.
361. 2,5324 г массасының дәлдігі:
A) 1 г
B) 0,1 г
C) 0,01 г
D) 0,001 г
*E) 0,0001 г
362. Аморфты тұнба түзілетін жағдайдағы гравиметриялық форманың массасы:
А) 0,01
*В) 0,1
С) 0,5
D) 1,0
Е) 10,0
363. Гравиметриялық фактор
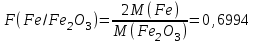 теңдеуінің бөліміндегі шама:
теңдеуінің бөліміндегі шама: A) Анықталатын заттың формуласы.
B) Аморфты тұнбаның формуласы.
C) Тұндырғыш.
*D) Гравиметриялық форма.
E) Тұндырылған форма.
364. Магнийдің гравиметриялық формасы:
A) MgCl2·6H2O
B) MgNH4PO4
*C) Mg2P2O7
D) Mg(OH)2
E) MgO
365. Никельдіанықтаудагравиметриялықформаалуүшінқолданылатыннегізгіқосылыс:
A) Ильинскийреактиві.
B) Аммиактыңконцентрліерітіндісі.
C) 8-оксихинолин.
*D) Диметилглиоксим.
E) Калийдіңконцентрліерітіндісі.
366. Алюминийді анықтауда гравиметриялық форма алу үшін қолданылатын негізгі қосылыс:
*A) 8-оксихинолин.
B) Аммиактың концентрлі ерітіндісі.
C) Ильинский реактиві.
D) Диметилглиоксим.
E) Калийдің концентрлі ерітіндісі.
367. Массаны өлшеуге негізделген талдау:
А) Фотометрия.
В) Потенциометрия.
С) *Гравиметрия.
Д) Амперометрия.
Е) Кулонометрия.
368. Гравиметриялық талдауда BaSO4↓ таза тұнбасын алу үшін тұндырғыш ретінде қолданылатын барий тұзы:
A) Ba(NO3)2
B) BaBr2
*C) BaCl2
D) Ba(ClO4)2
E) Ba(CH3COO)2
369. Гравиметриялық талдауда кальций оксалатын тұнбаға түсіру үшін қолданылатын қосылыс:
A) K2C2O4
B) Na2C2O4
C) H2C2O4
D) H2C2O4·2H2O
*E) (NH4)2C2O4
370. Кристалды тұнба түзілетін жағдайдағы гравиметриялық форманың массасы:
А) 0,01
В) 0,1
*С) 0,5
D) 1,0
Е) 10,0
371. Гравиметриялық талдауда сынама массасы анықталады:
А) Талданатын бастапқы заттың сипатымен.
В) Тұнбаға түсіруші реагенттің сипатымен.
*С) Тұндырылған форманың сипатымен.
D) Тұнбаға түсіру кезіндегі ортаның рН мәнімен.
Е) Тұнбаны күйдіру температурасымен.
372. 1 мл ерітіндідегі еріген заттың грамм мөлшері:
-
Молярлық концентрация. -
Эквивалентінің молярлық концентрациясы. -
Пайыздық мөлшер. -
*Титр. -
Анықталатын зат бойынша титр.
373. Көлемді дәл өлшеуге негізделген талдау:
А) Фотометрия.
В) Потенциометрия.
С) Гравиметрия.
Д) Титриметрия.
Е) Кулонометрия.
374. 100 г ерітіндіде еріген заттың грамм мөлшері:
-
Молярлық концентрация. -
Эквивалентінің молярлық концентрациясы. -
*Пайыздық мөлшер. -
Титр. -
Анықталатын зат бойынша титр.
375. Титрленген ерітінді:
-
Титрленентін ерітінді. -
Титрлейтін ерітінді. -
Титрлеу кезінде қолданылатын барлық ерітінді. -
*Концентрациясы дәл белгілі ерітінді. -
Концентрациясы шамамен белгілі ерітінді.
376. Бюретка дәлдігі:
-
1 мл -
0,5 мл -
0,0001 мл -
0,05 мл -
*0,02 мл
377. Бюретка көмегімен өлшенген жиырма бір миллилитр ерітіндінің дұрыс жазылуы:
-
21 мл -
21,0 мл -
*21,00 мл -
21,000 мл -
21,0000 мл
378. 1 литр ерітіндідегі еріген заттың эквивалент мөлшері:
-
Массалық үлес. -
Мольдік үлес. -
Молярлық концентрация. -
*Эквивалентінің молярлық концентрациясы. -
Молялды концентрация.
379. 1 литр ерітіндіде еріген зат мөлшері:
-
Массалық үлес. -
Мольдік үлес -
*Молярлық концентрация. -
Эквивалентінің молярлық концентрациясы. -
Молялды концентрация.
380. H3PO4 үшін эквиваленттік фактор мәндері болуы мүмкін:
-
1 -
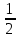
-
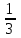
-
*Жүргізілген реакция теңдеуіне байланысты 1,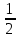 ,
, 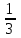 болуы мүмкін.
болуы мүмкін. -
Алынған қышқыл массасына байланысты 1,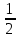 ,
, 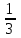 болуы мүмкін.
болуы мүмкін.
381. Сынаманы судың кез-келген мөлшерінде ерітіп, ерітіндісін титрлеуге негізделген әдіс:
-
Кері титрлеу. -
Орынбасу титрлеуі. -
Қалдық бойынша титрлеу. -
Пипетирлеу әдісі. -
*Жеке сынамалар әдісі.
382. Өлшеуіш колбасынан пипетка көмегімен белгілі бір көлемін алып, титрлеуге негізделген әдіс:
-
Кері титрлеу. -
Орынбасу титрлеуі. -
Қалдық бойынша титрлеу. -
*Пипетирлеу әдісі. -
Жеке сынамалар әдісі.
383. 0,05 МAl2(SO4)3 ерітіндісінің эквивалентінің молярлық концентрациясы:
-
0,05 -
0,1 -
0,2 -
*0,3 -
0,5
384. 0,6 н Bі(NO3)3 ерітіндісінің молярлық концентрациясы:
-
0,6 -
0,5 -
0,4 -
0,3 -
*0,2
385. Көлемі 50 мл 2 н НCl ерітіндісінен 0,1 н ерітінді алу үшін сұйылту керек:
-
200 мл дейін. -
500 мл дейін. -
*1000 мл дейін. -
2000 мл дейін. -
5000мл дейін.
386.10 гNaOH бар 250 мл ерітіндінің титрі(г/мл):
-
4 -
0,25 -
25 -
*0,04 -
0,4
387. 1 н NH4OH ерітіндісінің титрі(г/мл):
-
1 -
0,5 -
0,01 -
*0,035 -
35
388. 4,9 гH2SO4 бар 1 литр ерітіндінің эквивалентінің молярлық концентрациясы (моль/л):
-
1,0 -
0,5 -
*0,1 -
0,05 -
0,01
389. Титрі 0,003651 г/млHCl ерітіндісінің эквивалентінің молярлық концентрациясы (моль/л):
-
1,0 -
0,5 -
*0,1 -
0,05 -
0,01
390. Көлемі 20 мл 0,03 н FeSO4 ерітіндісін титрлеу үшін 0,02 нKMnO4 ерітіндісінің қажет көлемі(мл):
-
10 -
20 -
*30 -
40 -
50
391. Көлемі 3 литр 0,1 н HNO3 ерітіндісін дайындау үшін 2 н ерітіндісінің қажет көлемі(мл):
-
100 -
*150 -
200 -
500 -
1000
392. Эквивалентінің молярлық концентрациясы 0,1 моль/л, көлемі 100 мл натрий карбонаты ерітіндісін дайындау үшін қажет тұздың массасы (М(Na2CO3) = 106 моль/л):
A) 53 г
B) 53·10-1 г
*C) 53·10-2 г
D) 53·10-3 г
E) 53·10-4 г
393. Ортофосфор қышқылының эквивалентінің молярлық массасы (г/моль):
A) 98
B) 49,53
C) 97
D) 82,59
*E) 32,67
394. Титрант қышқыл болатын әдіс:
A) Перманганатометрия.
B) Алкалиметрия.
C) *Ацидометрия.
D) Потенциометрия.
E) Комплексонометрия.
395. 20 мл ерітіндіні титрлеуге 21,64 мл 0,05 н натрий хлориді жұмсалды, ерітіндідегі күміс ионының мөлшері:
A) *116 г
B) 6,2 г
C) 0,058 г
D) 5,81 г
E) 62 г
396. NaOH бірінші стандарт ретінде:
A) Жабық бюкске өлшенсе қолданылады.
B) *Ауадан CO2 сіңіреді, сондықтан қолданылмайды.
C) Сатылатын препаратты қолдануға болады.
D) Сатылатын препаратты қолдануға болмайды.
E) Сақтағанда құрамы өзгермейді, сондықтан қолданылады.
397. 2,45 г күкірт қышқылы бар 500 мл ерітіндінің эквивалентінің молярлық концентрациясы (моль/л):
A) 0,05
B) 5·10-5
*C) 0,1
D) 0,5
E) 10-3
398. Натрий гидроксидінің эквивалентінің молярлық массасы (г/моль):
*A) 40
B) 56
C) 98
D) 53
E) 49
399. 0,365 г хлорсутегі еріген 100 мл ерітіндінің эквивалентінің молярлық концентрациясы (моль/л):
-
0,001 -
0,01 -
*0,1 -
1 -
2
400. Эквивалентінің молярлық концентрациясы 0,1 моль/л 100 мл ерітіндідегі күкірт қышқылының массасы (г):
-
4,90 -
*0,49 -
9,80 -
0,98 -
98,00
401. Тығыздығы1,025 г/см3тең болатын 100 мл ерітіндідегі тұз қышқылының массасы (г):
-
1025,00 -
*102,50 -
10,25 -
1,025 -
1,13
402. Эквивалентінің молярлық концентрациясы 0,1 моль/л 200 мл ерітіндідегі калий гидроксидінің массасы (г):
-
56 -
5,6 -
0,56 -
*1,12 -
11,2
403. Көлемі 1 л 0,05 н H2SO4 ерітіндісін даярлау үшін, 0,1 н ерітіндісінен алынатын көлемі (мл):
-
*500 -
100 -
50 -
10 -
5
404. Титрі 0,005300 г/мл, 100 мл стандартты ерітінді дайындауға қажет натрий карбонатының массасы (г):
А) 0,1060
В) 1,0600
С) 0,0053
*D) 0,5300
Е) 0,0530
405. Массасы 0,53 г натрий карбонаты еріген 1 л ерітіндінің титрі (г/мл):
A) 5,3 ·10-1
B) 5,3 ·102
C) 1,87
D) 1,87·10+3
*E) 5,3·10-4
406. Массасы 0,365 г HCl еріген 100 мл ерітіндінің эквивалентінің молярлық концентрациясы (моль/л):
A) 0,001
B) 0,01
*C) 0,1
D) 1
E) 2
407. H3PO4 + 2KOH = K2HPO4 + 2H2O реакциясындағы H3PO4 эквиваленттік факторы:
A) 1
B) *

C)

D) 3
E) 5
408. Na2CO3 + HCl = NaHCO3 реакциясындағы Na2CO3 эквиваленттік факторы:
A) *1
B)

C) 2
D)

E) 5
409. H3PO4 + 2KOH = K2HPO4 + 2H2O реакция теңдеуіндегі фосфор қышқылының эквиваленттік факторы:
A) 1
*B)

C) 
D) 3
E) 5
410. Na2CO3 + HCl = NaHCO3 + NaCl реакция теңдеуіндегі натрий карбонатының эквиваленттік факторы:
*A) 1
B) 
C) 2
D) 4
E) 0
411. Cr2(SO4)3 + Cl2 + KOH = K2CrO4 + KCl + K2SO4 + H2O тотығу-тотықсыздану реакциясындағы хром ионының эквиваленттік факторы:
A)

B)

C)
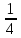
D)
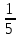
E) *
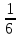
412. Mn(NO3)2 + PbO2 + HNO3=HMnO4 + Pb(NO3)2 + H2O тотығу-тотықсыздану реакциясындағы марганец ионының эквиваленттік факторы:
A)

B)
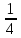
C) *
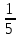
D)