Файл: 1. Элементарлы талдау а талданатын заттаы жеке компоненттерді анытайтын сапалы жне санды талдау дістері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 1536
Скачиваний: 1
СОДЕРЖАНИЕ
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
*С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
A) Сұйылтылған азот қышқылымен.
A) Сұйылтылған хлорсутек қышқылы.
A) Калийдің гексанитрокупраты(II).
B) Қорғасынның гексанитрокупраты(II).
C) Натрийдің гексанитрокупраты(II).
*D) Калий және қорғасынның гексанитрокупраты(II).
*A) Қаныққан натрий карбонаты ерітіндісімен өңдеу
A) Концентрлі аммиак ерітіндісі.
B) Қаныққан натрий карбонаты ерітіндісі.
A) Концентрлі аммиак ерітіндісі.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
201. АmBn жүйесі үшін тұнбаның түзілу жағдайы ( ):
A) КS мәні температураға тәуелді емес.
B) Температура жоғарылаған сайын Кsмәні артады.
222. Комплекстүзу реакциясы арқылы ерітіндіге нашар өтетін тұнба:
*A) Оствальдтың сұйылту заңына.
*A) Оствальдтың сұйылту заңына.
D) Тұнбаға түсіру кезіндегі ортаның рН мәнімен.
А) Массаларының қатынасы 1:10.
В) Көлемдерінің қатынасы 1:10.
*Е) Эквивалент мөлшерлерінің қатынасы 1:1.
*C) Индикатормен де, индикаторсыз да.
*A) Жұтылу спектрі - жұтылған жарықтың толқын ұзындығы.
A) Электромагнитті сәулеленудің табиғатын білу үшін.
*A) Жұмысшы электроды потенциалы – титрант көлемі.
*A) Жартылай толқын потенциалдардың айырымын арттыру үшін
B) Оптикалық жұтылу мен жұтылу қабатындағы толқын ұзындығыарасындағы сызықтық байланыс.
C) Оптикалық жұтылу мен жарық жұтылуындағы толқын ұзындығы арасындағы сызықтық байланыс.
D) Молярлық жұтылу мен толқын ұзындығы арасындағы сызықтық байланыс.
A) Тұрақты ток күшіндегі кулонометрия.
*A) Ток күшінің уақытқа көбейтіндісі.
B) Кернеудің уақытқа көбейтіндісі.
A) 1,15
B) 2,20
C) 3,50
D) 4,50
*E) 2,63
311. Буферлік сыйымдылық сақталатын шек:
A) pH = pK
B) pH = pK + 5
C) *pH=pK
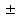 1
1D) pH=pK- 5
E) pH = pK - 4
312. Магний ионын натрий гидрофосфатымен анықтау кезінде қолданылатын буфер жүйесі:
A) Na2HPO4 + NaH2PO4
B) CH3COOH + CH3COONa
C) HCOOH + HCOONa
*D) NH4OH + NH4Cl
E) H2CO3 + NaHCO3
313. 2BaCl2 + K2Cr2O7 + H2O = 2BaCrO4 + 2KCl + 2HCl реакциясын жүргізу үшін қажетті буфер жүйесі:
A) Na2HPO4 + NaH2PO4
*B) CH3COOH + CH3COONa
C) HCOOH + HCOONa
D) NH4OH + NH4Cl
E) H2CO3 + NaHCO3
314. Қышқылдық буфер жүйесі:
A) Әлсіз қышқыл және оның әлсіз негізбен қосылған тұзы.
B) Күшті негіз және оның әлсіз қышқылмен қосылған тұзы.
C) Күшті қышқыл және оның әлсіз негізбен қосылған тұзы.
*D) Әлсіз қышқыл және оның күшті негізбен қосылған тұзы.
E) Күшті қышқыл және оның күшті негізбен қосылған тұзы.
315. Негіздік буфер жүйесі:
A) Күшті негіз және оның күшті қышқылмен қосылған тұзы.
B) Күшті қышқыл және оның әлсіз негізбен қосылған тұзы.
C) Әлсіз негіз және оның әлсіз қышқылмен қосылған тұзы.
*D) Әлсіз негіз және оның күшті қышқылмен қосылған тұзы.
E) Күшті негіз және оның әлсіз қышқылмен қосылған тұзы.
316. Ацетат буферінің қышқылмен өзара әрекеттесуінің молекулалық теңдеуі:
A)
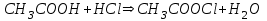
B)
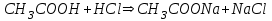
*C)
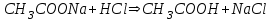
D)
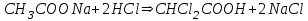
E)
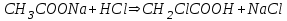
317. Негіздік буфер жүйелеріне арналған Гендерсон-Гассельбах теңдеуі:
A)

*B)
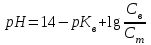
C)

D)

E)
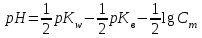
318. Аммиакты буфер жүйесінің рН мәнін есептейтін формула:
A)

*B)
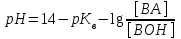
C)
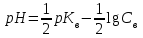
D)

E)

319. Қышқылдық буфердің рН мәнін есептейтін формула:
A)

*B)
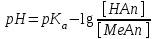
C)

D)

E)

320. K(NH4OH) = 10-5 тең, 0,1 н NH4OH ерітіндісіне концентрациясы 0,1 моль/л болғанға дейін қатты NH4Clқосылды, осы кездегі
 иондарының концентрациясы:
иондарының концентрациясы:-
10-1 -
10-2 -
10-3 -
10-4 -
*10-5
321. K(CH3COOH) = 10-5 тең, 0,001 н CH3COOH ерітіндісіне концентрациясы 0,001 моль/л CH3COONa ерітіндісі қосылғаннан кейінгі буфер ерітіндісінің рН:
A) 1
B) 2
C) 3
D) 4
*E) 5
323. 0,001 М CH3COOH және 0,001 М CH3COONa ерітінділерінің бірдей көлемдерін араластырғанда түзілген буфер жүйесінің рН (К(CH3COOH)=1,74·10-5):
A) 1,22
B) 2,29
C) 3,47
*D) 4,75
E) 6,03
324. 0,1 М CH3COOH және 0,1 М CH3COONa ерітінділерінің бірдей көлемдерін араластырғанда түзілген буфер жүйесінің рН (К(CH3COOH)=1,74·10-5):
A) 1,05
B) 2,66
C) 3,92
*D) 4,75
E) 6,16
325. Қатынастары бірдей (1:1) концентрациялары 0,1 моль/л H2CO3 және NaHCO3 тұратын буфер ерітіндісінің pH (Кa = 4,5·10-7):
*А) 6,35
В) 7,35
С) 3,5
D) 4,0
Е) 4,75
326. Қатынастары бірдей (1:1) концентрациялары 0,1 моль/л аммиак пен аммоний хлоридінен тұратын буфер ерітіндісінің pH (Кв = 1,76·10-5):
А) 5,0
В) 6,3
С) 7,0
D) 8,3
*Е) 9,2
327. Қышқыл концентрациясы 0,1 моль/л (Ка = 10-6), тұз концентрациясы 0,01 моль/л тең болатын буфер жүйесінің рН:
-
1 -
3 -
*5 -
7 -
9
328. Негіз концентрациясы 0,05 моль/л (Кв= 10-7), тұз концентрациясы 0,5 моль/л тең болатын буфер жүйесінің рН:
-
2 -
4 -
*6 -
8 -
10
329. Негіздік буфер жүйесін 100 есе сұйылтқанда рНмәні:
-
10 есеартады. -
2 есеартады. -
*өзгермейді. -
2 есе кемиді. -
10 есе кемиді.
330. Қышқылдық буфер жүйесін 100 есе сұйылтқанда рНмәні:
-
10 есе артады -
2 есе артады -
*өзгермейді -
2 есе кемиді -
10 есе кемиді
331. Буферлік әсері бар қоспа:
-
CH3COOK + CH3COONa -
*CH3COOH + CH3COONa - 1 ... 10 11 12 13 14 15 16 17 ... 72
NH4Cl + NaCl
NaCl + HCl
CH3COOH + HCOOH
332. Буферлік әсері бар ерітінді:
А) Күшті қышқылдардың сұйылтылған ерітінділері.
*В) Әлсіз қышқыл мен оның күшті негізбен қосылған тұзы.
С) Күшті негіздердің сұйылтылған ерітінділері.
D) Күшті қышқыл мен күшті негіздің қоспасы.
Е) Күшті қышқыл мен оның күшті негізбен қосылған тұзы.
333. Сутектік көрсеткіші 7,53 тең, қанның сутегі ионының концентрациясы
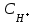 :
:A) 2,95·10-6
B) 2,95·10-7
*C) 2,95·10-8
D) 2,95·10-9
E) 2,95·10-10
334. Буферлік жүйелерді минималды мәннен максималды мәнге дейін өзгерту үшін қолданылатын қатынас:
*A)
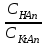
B)
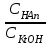
C)
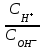
D)
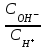
E)
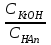
335. Ацетат буфері ерітіндісінің сутегі ионы концентрациясын есептейтін формула:
A)
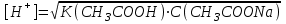
*B)
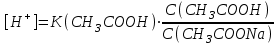
C)
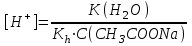
D)

E)
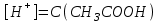
336. CH3COOH және CH3COONa қоспасы:
A) Аммоний буфері.
B) Гемоглобин буфері.
C) Оксигемоглобин буфері.
*D) Ацетат буфері.
E) Фосфат буфері.
337. NaH2PO4 және Na2HPO4 қоспасы:
A) Аммоний буфері.
B) Гемоглобин буфері.
C) Оксигемоглобин буфері.
D) Ацетат буфері.
*E) Фосфат буфері.
338. NH4OH және NH4Cl қоспасы:
*A) Аммоний буфері.
B) Гемоглобин буфері.
C) Оксигемоглобин буфері.
D) Ацетат буфері.
E) Фосфат буфері.
339. HHbO2 және KHbO2 қоспасы:
A) Аммоний буфері.
B) Гемоглобин буфері.
*C) Оксигемоглобин буфері.
D) Ацетат буфері.
E) Фосфат буфері.
340. HHb және KHb қоспасы:
A) Аммоний буфері.
*B) Гемоглобин буфері.
C) Оксигемоглобин буфері.
D) Ацетат буфері.
E) Фосфат буфері.
341. Реакция ортасының рН = 4,7 болу үшін қолданылатын буфер:
*A) Ацетат буфері.
B) Аммоний буфері.
C) Формиатбуфері.
D) Гидрокарбонат буфері.
E) Фосфат буфері.
342. Реакция ортасының рН = 9,3 болу үшін қолданылатын буфер:
A) Ацетат буфері.
*B) Аммоний буфері.
C) Формиатбуфері.
D) Гидрокарбонат буфері.
E) Фосфат буфері.
343. Реакция ортасының рН = 7,2 болу үшін қолданылатын буфер:
A) Ацетат буфері.
B) Аммоний буфері.
C) Формиатбуфері.
D) Гидрокарбонат буфері.
*E) Фосфат буфері.
344. Реакция ортасының рН = 3,7 болу үшін қолданылатын буфер:
A) Ацетат буфері.
B) Аммоний буфері.
*C) Формиатбуфері.
D) Гидрокарбонат буфері.
E) Фосфат буфері.
345. Буферлік сиымдылық сақталатын аудан:
A)
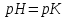
B)
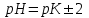
*C)
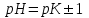
D)
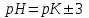
E)
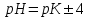
346. Күшті қышқыл мен әлсіз негізден тұратын тұздың рН мәнін есептейтін формула:
A)

B)

C)

*D)

E)

347. Эквивалентінің молярлық концентрациясы 0,1 моль/л, рКа = 3,75 тең болатын натрий формиаты ерітіндісінің рН:
A) 8,5
B) 7,2
*C) 8,4
D) 9,3
E) 10,9
348. НСООNa тұзы үшін ОН- ионының концентрациясын есептейтін формула:
-
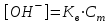
-
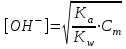
-
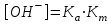
-
*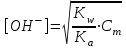
-
