Файл: Конспект лекций для студентов специальности 1 48 01 02 Химическая технология органических веществ, материалов и изделий.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 1279
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и определения
Направленность ковалентной связи. Гибридизация орбиталей
Насыщаемость ковалентной связи
5 Общие свойства растворов. Идеальные растворы. Законы Рауля
Если в раствор добавить, например гидроксид натрия
Влияние pH на растворимость электролитов
Преимущественное направление ионно-молекулярных реакций
Получение заданного вещества реакцией обмена
Восстановители-металлы (простые вещества)
Составление материального баланса в полуреакциях
Комплексные соединения в окислительно-восстановительных реакциях
Электронный баланс в полуреакциях
Уравнение Нернста для металлического электрода
Электрохимический ряд металлов
Материальный баланс электрохимических реакций. Законы Фарадея
Таблица А.1 – Константы ионизации некоторых кислот и оснований
– магнитный орбитальный момент движения электрона, пропорционально числу ml – магнитному орбитальному квантовому числу.
Кроме того, любой электрон, в том числе и не связанный с ядром, имеет собственный магнитный момент (спин) ms = ±1/2:
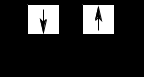
Согласно уравнению Шредингера, для главного квантового числа (n) возможны только целочисленные значения n = 1,2,3, …
Физический смысл квантовых чисел, связь их с понятиями: энергетический уровень, подуровень(s‑, p-, d‑, f-,..), орбиталь. Форма электронных орбиталей и их пространственная ориентация относительно ядра атома
Состояние электронов с определенным n называют уровнем. Если n = 1, то это первый уровень, если n = 2, то это второй уровень и т.д. Из того, что максимальная величина n не ограничена, следует, что в любом атоме – бесчисленное множество энергетических уровней.
Для орбитального квантового числа (l) возможны целочисленные значения по (n–1) включительно, а также «ноль», т.е. l = 0,1,2,3, …(n–1).
Состояние электронов с определенным l называют подуровнем. Число подуровней определяется величиной n для этого уровня:
– если n = 1 (первый уровень), то возможно только одно значение l = 0, поэтому на первом уровне – только один подуровень;
– если n = 2 (второй уровень), то возможно два значения l = 0 и 1, поэтому на втором уровне – два подуровня.
Легко убедиться, что число подуровней равно величине n: на третьем уровне (n = 3) – три подуровня, на четвертом – четыре и т.д.
Подуровни (s-, p-, d-, f- и т.д.) различаются величиной орбитального квантового числа l: подуровень с l = 0 называют s – подуровнем, l = 1 – p-подуровнем, l = 2 – d-подуровнем, l = 3 – f-подуровнем, (далее, при больших l, символы присваивают в порядке латинского алфавита).
Величина l определяется также формой электронных орбиталей (рисунок 2.1.). Орбитали с равным l, но с разным n (например, 1s и 2s) одинаковы по форме, но различаются размерами: орбитали с большим n имеют больший размер (т.к. при большем n они более удалены от ядра).
Для магнитного орбитального квантового числа (ml) возможны целочисленные значения от –l до +1, включая «ноль», т.е. всего (2l + 1) значений.
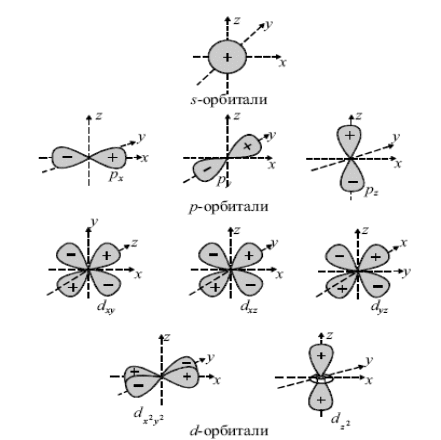
Рисунок 2.1 – Форма атомных орбиталей
Число возможных значений ml для данного подуровня определяет число вариантов ориентации орбитали в пространстве (и соответственно число этих орбиталей на подуровне). Например, для s-подуровня (l = 0) возможно только одно значение ml= 0, поэтому на s-подуровне только одна орбиталь. Для p-подуровня l = 1, и для ml возможны три значения: –1, 0, +1, поэтому на p-подуровне три орбитали, ориентированные вдоль осей XYZ декартовой системы координат (обозначаются, соответственно px, py, pz). Легко показать, что на d-подуровне – пять орбиталей, на f- подуровне – семь и т.д. (нечетный ряд).
Еще раз подчеркнем, что изложенные принципы квантования состояний обязательны для электрона, связанного с ядром. Свободные электроны (β-частицы, например) могут иметь любую энергию, не подчиняясь правилам квантования, кроме ms = ±1/2).
Три квантовых числа (n, l, ml) однозначно определяют конкретную орбиталь в атоме. Например, если n = 3, l = 1, ml = 0, то это орбиталь третьего уровня, p-подуровня, ориентированная вдоль оси Z. Если требуется указать «адрес» конкретного электрона в атоме, то кроме «адреса» его орбитали (n, l, ml) требуется указать знак спина: ms = +1/2 или ms = – 1/2.
Принцип Паули. Электронная емкость орбитали, подуровня, уровня
Согласно принципу Паули, в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Пример: Если для одного из электронов в атоме n = 3, l = 1, ml= 0, ms = +1/2, то другие электроны должны иметь хотя бы одно квантовое число другое, а именно: или другое n, т.е. находиться на другом уровне, или другое l, т.е. находиться на другом подуровне, или другое ml, т.е. находиться на другой орбитали, или иметь те же n, l, ml, но иметь противоположный по знаку спин.
Из последнего варианта следует, что на каждой атомной орбитали, характеризующейся определёнными значениями n, l, ml, может находиться не более двух электронов, причём спины этих электроновдолжны бытьпротивоположными по знаку.(Так как только в этом случае три квантовых числа, n, l, ml этих электронов будут одинаковыми, но спины – разными: у одного электрона ms = +1/2, у другого ms
= –1/2).
| Обозначение неспаренного электрона на атомной орбитали, если ms = +1/2 | Обозначение двух спаренных электронов с противоположными спинами, находящихся на одной атомной орбитали |
Зная число орбиталей на подуровне (одна – на s-, три – на p-, пять – на d- и семь – на f-) и с учетом того, что на одной орбитали может быть не более двух электронов, легко определить, что на s-подуровне быть до двух электронов, на p-подуровне – до 6, на d-подуровне – до десяти и на f-подуровне – до четырнадцати электронов. Соответственно на первом уровне (только 1s-подуровень) может быть один или два электрона; на втором уровне (2s- и 2p- подуровни) – до 8 электронов; на третьем уровне (включающем подуровни s-, p-, d-) может быть до 18 электронов: 2 + 6 + 10.
Относительная энергия уровней и подуровней
Для одноэлектронного атома водорода относительная энергия подуровней определяется, прежде всего, величиной главного квантового числа: меньшую энергию имеет подуровень с меньшим n. В пределах одного и того же уровня энергия подуровней увеличивается в ряду Еs < Еp < Еd < Еf , и в атоме водорода относительная энергия подуровней будет следующая: 1s2s2p3s3p3d4s4p4d4f5s5p5d5f5g6s…
В многоэлектронных атомах на энергию электронов влияет не только притяжение их к ядру, но и межэлектронное отталкивание. В результате относительная энергия некоторых подуровней меняется по сравнению с атомом водорода.
В многоэлектронных атомах меньшую энергию имеет подуровень с меньшей суммой (n + l); при равной сумме (n + l) меньшую энергию имеет подуровень с меньшим n.
Выпишем последовательность, определенную для атома водорода, и проставим для каждого подуровня сумму (n + l):
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5g 6s…
∑(n + l): 1 2 3 3 4 5 4 5 6 7 5 6 7 8 9 6
А теперь, выполнив перестановки в соответствии с приведенными выше правилами, расположим подуровни в порядке увеличения их энергии:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d…
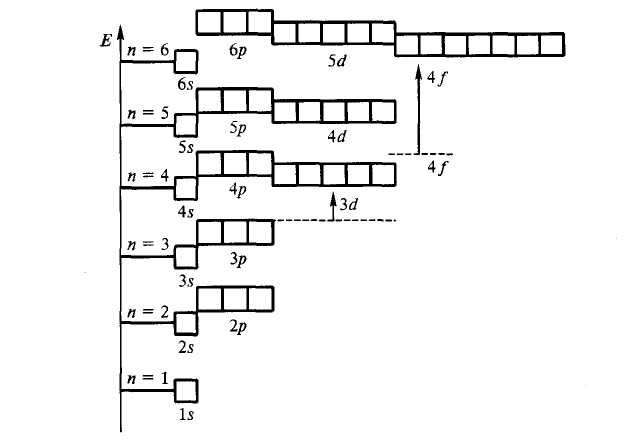 На рисунке 2.2 показана энергетическая диаграмма атомных орбиталей многоэлектронного атома.
На рисунке 2.2 показана энергетическая диаграмма атомных орбиталей многоэлектронного атома.

Рисунок 2.2 – Энергетическая диаграмма атомных орбиталей многоэлектронного атома
Порядок заполнения электронами орбиталей подуровней, уровней. Электронные и электронно-графические формулы атомов
Порядок заполнения определяется принципом наименьшей энергии: вначале заполняются орбитали, на которых энергия электрона будет меньшей.
При этом кроме приведенного выше ряда относительной энергии подуровней и принципа Паули необходимо учесть правила Гунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах подуровня, при котором абсолютное значение суммарного спина максимально.
Пример: распределить три электрона на p-подуровне в соответствии с правилом Гунда.
| а | б |
При варианте (б) абсолютная величина суммарного спина равна 3/2; при варианте (а) равна 1/2. Очевидно, что правилу Гунда соответствует вариант (б).
Правило Гунда не запрещает другого распределения электронов в пределах подуровня (на то оно и «правило», а не закон), однако другие варианты возможны при возбуждении атомов (такие варианты встретятся при рассмотрении химических связей в комплексных соединениях).
Распределение электронов по подуровням показывают электронные конфигурации (электронные формулы) атомов. Например, в атоме с зарядом ядра Z = +11 имеются 11 электронов, которые распределятся по подуровням следующим образом: 1s22s22p63s1– это и есть электронная конфигурация (формула) атома с Z = +11.
Что получится для атома с Z = +23?: 1s2 2s2 2p6 3s2 3p6 4s2 3d3 – Эта последовательность заполнения соответствует приведенным ранее правилам, но в отличие от предыдущего примера – это пока не еще не электронная формула. Дело в том, что подуровень 3d выше по энергии, чем 4s до тех пор, пока он вакантный. При появлении на 3d первого же электрона энергия его понижается по сравнению с 4s. В результате действительной электронной формулой атома с Z = +23 будет 1s22s22p63s23p63d34s2.
Подобные перестановки приходится делать во всех случаях, когда при распределении электронов «последние» оказываются на d- или f-подуровне. По этой причине в таких атомах всех элементов внешние электроны – на s-подуровне.
«Проскок» электрона
«Проскок» проявляется в том, что при заполнении d- или f-подуровней возможен переход на них электрона с внешнего s- подуровня: ns (n – 1)d.
«Проскок» чаще наблюдается в тех случаях, когда при распределении электронов в атоме на (n–1)d-подуровне оказывается четыре или девять электронов (т.е. не хватает одного электрона до завершения подуровня наполовину или полностью). В результате «проскока» электронные формулы атомов с зарядами ядер, например Z = +24 (Сr) и Z = 29 (Cu) оказываются не 1s22s22p63s23p63d44s2 и 1s22s22p63s23p63d94s2, а 1s22s22p63s23p63d54s1 и 1s22s22p63s23p63d104s1 соответственно. Особенно часто «проскок» наблюдается у атомов пятого периода; в атоме палладия – двойной «проскок», и на внешнем 5s-подуровне нет ни одного электрона. Для f-подуровней закономерности более сложные.
Физический смысл Периодического закона Д.И.Менделеева. Cтруктура таблицы элементов
Физический смысл периодического закона заключается в том, что с изменением зарядов ядер атомов (и соответственно общего числа электронов в атоме) периодически повторяется электронное строение внешнего (валентного) уровня атомов, а вследствие этого периодически повторяются химические свойства элементов и их соединений.
Поэтому свойства атомов элементов, образуемых ими простых веществ и других химических соединений находятся в периодической зависимости от зарядов ядер атомов (современная формулировка Периодического закона).
Периодическая таблица элементов является графическим изображением периодического закона. Из многих форм такого изображения наиболее широко используются три: а) короткая (8‑клеточная), б) полудлинная (18-клеточная), в) длиннопериодная (32-клеточная).
В вариантах (а) и (б) элементы – лантаноиды и актиноиды вынесены в нижнюю часть таблицы или в отдельные группы.
Физической основой структуры таблицы