Файл: Конспект лекций для студентов специальности 1 48 01 02 Химическая технология органических веществ, материалов и изделий.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 1262
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и определения
Направленность ковалентной связи. Гибридизация орбиталей
Насыщаемость ковалентной связи
5 Общие свойства растворов. Идеальные растворы. Законы Рауля
Если в раствор добавить, например гидроксид натрия
Влияние pH на растворимость электролитов
Преимущественное направление ионно-молекулярных реакций
Получение заданного вещества реакцией обмена
Восстановители-металлы (простые вещества)
Составление материального баланса в полуреакциях
Комплексные соединения в окислительно-восстановительных реакциях
Электронный баланс в полуреакциях
Уравнение Нернста для металлического электрода
Электрохимический ряд металлов
Материальный баланс электрохимических реакций. Законы Фарадея
Таблица А.1 – Константы ионизации некоторых кислот и оснований
Например, у элементов 3 периода (от Na до Ar) внешние валентные электроны находятся на 3-м энергетическом уровне, а у элементов 6 периода (от Cs до Rn) – на 6-м. Поэтому элементы со структурами валентного уровня 6s1, 6s26p3, 5d76s2, 4f36s2 находятся в шестом периоде.
В группыобъединены элементы, атомы которых имеют одинаковое число валентных электронов.
Например, атомы элементов четвертой (IV) группы имеют по четыре валентных электрона, а атомы седьмой группы – по семь.
Группыэлементов А или В («главные» или «побочные») объединяют элементы с одинаковым распределением валентных электронов по подуровням.
Если все валентные электроны занимают орбитали внешнего уровня (s-, p-подуровни), то подгруппа главная (А); если часть валентных электронов на внешнем s-подуровне, а остальные на предвнешних d- или f-, то подгруппа побочная (В).
Например, элементы со структурой валентного уровня атомов 3s1, 4s2, 3s23p1, 6s26p4 находятся в главных подгруппах (в первой, второй, третьей и шестой группах соответственно); элементы со структурой валентного уровня атомов 3d14s2, 4d35s2, 4f76s2 – в побочных подгруппах (третьей, пятой и третьей групп соответственно).
Обратите внимание, что для элементов VIII группы (так называемых «триад»: Fe, Co, Ni; Ru, Rh, Pd; Os, Ir, Pt) число валентных электронов, равное номеру группы, т.е. по 8, имеют только первые элементы «триад»: Fe (3d64s2), Ru (4d75s1), Os(5d66s2). Атомы каждого последующего элемента «триады» имеют на один электрон больше. Атомы элементов, у которых часть валентных электронов занимают f-подуровень, относятся к III группе, «лантаноидам и «актиноидам».
В химических превращениях участвуют только валентные электроны и орбитали атомов, поэтому для решения практических задач достаточно показать электронное строение только валентного уровня атома. Электронные конфигурации (формулы) атомов, показывающие распределение по подуровням только валентных электронов, называют сокращенными электронными формулами. Электронно-графические формулы атомов показывают распределение электронов по уровням, подуровням и орбиталям.
Зная физические принципы построения периодической таблицы, сокращенную электронную формулу атома можно написать, минуя написание полной формулы, по «адресу» элемента в периодической таблице (период, группа, подгруппа).
Например, если элемент расположен в 4-м периоде, V группе, главной подгруппе (А), то внешние валентные электроны в его атоме занимают 4-й энергетический уровень (т.к. период 4-й). Из того, что подгруппа – главная, следует, что валентные электроны – все на внешнем уровне и занимают s- и p‑ подуровни (4s4p). Из того, что группа пятая, следует, что валентных электронов пять; с учетом электронной емкости подуровней (см. принцип Паули) получим следующую сокращенную электронную формулу: 4s24p3, а также и соответствующую ей сокращенную электронно-графическую формулу:
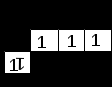
Аналогично для элемента того же 4-го периода и той же V группы, но побочной подгруппы (В) получим сокращенную электронную формулу 3d34s2, т.к. из пяти валентных электронов только два – на внешнем четвертом уровне (4s-подуровне), а остальные три – на предвнешнем 3d-подуровне. Такому распределению электронов соответствует следующая сокращенная электронно-графическая формула:
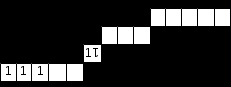
Обратите внимание, что для металлов групп В к валентным относятся d-орбитали как предвнешнего, так и внешнегоуровня.
Семейства элементов
Семейство элемента (s-, p-, d- или f-) определяется тем подуровнем (s-, p-, d- или f-), который заполнялся последним. Элементы со строением валентного уровня атомов 3s1, 5s2 относятся к s‑семейству (s‑элементам); 4s24p1, 5s25p5 – к p-семейству, 3d34s2, 4d105s2 – к d‑семейству;
4f116s2 – к f‑семейству.
Элементы s-, p-семействв периодической таблице составляют главные подгруппы (или группы А), а элементы d- , f-семейств – побочныеподгруппы(или группы В).
В заключение этого раздела отметим, что наиболее простой и надежный способ определения главных и побочных подгрупп в короткой (8-клеточной) форме периодической таблицы основан на том, что во второмпериоде все элементы – в главных подгруппах (т.к. на втором уровне нет d-подуровня). Поэтому все элементы, расположенные под ними – тоже в главных подгруппах.
Свойства атомов. Периодичность в изменении свойств атомов как следствие периодичности в изменении их электронных структур. Свойства атомов и свойства элементов
При анализе химических свойств элементов существенными являются следующие характеристики атомов:
– орбитальный радиус, r (условная величина) – расстояние от ядра до максимума плотности внешнего электронного облака; измеряется в метрах (СИ), чаще – в нанометрах (1нм = 10–9 м) или в ангстремах (1А = 10–10 м). Радиус атома примерно в 105 раз больше радиуса его ядра;
– энергия (или потенциал) ионизации атома, I, характеризует способность атома отдавать электроны, превращаясь в катион: А А+ + e–; измеряется в кДж/моль (СИ), иногда в эВ/атом (1 эВ/атом = 96 кДж/моль);
– сродство к электрону, Е, характеризует способность атома присоединять дополнительный электрон, превращаясь в анион:
А + e– А–, кДж/моль
– электроотрицательность, , – условная величина, характеризует способность атома смещать к себе электронную плотность связи с другим атомом. На практике чаще применяют шкалу не абсолютных, а относительных электроотрицательностей (ОЭО), в которой самым электроотрицательным является атом фтора, а наименее – атом франция.
Периодичность в изменении свойств атомов определяется периодичностью в формировании их электронных оболочек. Так, у атомов элементов одного периода внешние электроны находятся на одном и том же энергетическом уровне (т.е. примерно на одинаковом расстоянии от ядра), поэтому r атомов элементов одного периода примерно равны (уменьшаясь слева направо с увеличением заряда ядра из-за увеличения притяжения электронов к ядру).
В главных подгруппах с увеличением номера периода валентные электроны атомов располагаются на все более удаленном от ядра энергетическом уровне, и поэтому r
увеличиваются. Однако в побочных подгруппах радиусы меняются мало, т.к. в атомах элементов побочных подгрупп электронами заполняются внутренние d‑ или f‑подуровни (атомы «сжимаются»).
Периодичность в изменении I, Е, ЭО является следствием периодичности в изменении радиусов атомов. Учитывая, что природа сил притяжения электронов к ядру – электростатическое их взаимодействие описывается законом Кулона, F =q1∙q2/r2, очевидно: чем больше r или чем меньше заряд ядра атома, тем меньшими должны быть его I, Е, ЭО.
Примеры: Сравнить r, I, Е, ЭО () атомов:
а) Са и Ва; б) Са и Ge; в) Cu и Au.
Решение: а) Са и Ва – элементы одной главной подгруппы II группы, следовательно, rBa> rCa, а тогда ICa > IBa, ЕCa > ЕBa, Ca > Ba;
б) Ca и Ge – элементы одного периода, следовательно, rCa rGe, причем, ZCa< ZGe, а тогда ICa< IGe, ЕCa < ЕGe и Ca< Ge;
в) Cu и Au – элементы одной, побочной, подгруппы, следовательно:
rСu rAu, но т.к. ZCu < ZAu, то ICu < IAu, ECu < EAu, Cu < Au.
Примечание: при анализе справочных данных по свойствам атомов можно заметить, что в периодах и группах они меняются не всегда однозначно, как описано выше. Некоторые из этих «несоответствий» закономерны, например, при переходе к атомам с наполовину или полностью завершенными np- или (n – 1)d-подуровнями валентного уровня. Другие объяснить гораздо сложнее (см. следующую тему).
Металлы и неметаллы в таблице элементов. Периодичность в изменении свойств элементов и их соединений
В рамках химических представлений элементы делятся на металлы и неметаллы, исходя из способности их атомов отдавать и принимать электроны: для металлов более характерно отдавать, а для неметаллов – принимать электроны. Учитывая, что эти свойства атомов характеризуются величинами I, E, , можно предположить, что чем меньше I и для атомов элементов, тем большие металлические и меньшие неметаллические свойства для них характерны.
На самом деле связь отдельных свойств атомов с металлическими (неметаллическими) своствами простых вещест не такая простая. Например, сродство к электрону у атомов бериллия и магния равное, а для атомов всех (кроме лития) элементов 2 периода оно меньше, чем у расположенных ниже элементов 3 периода, хотя неметаллические свойства более выражены у элементов, расположенных в подгруппах выше. Еще более неожиданно сравнение элементов одного периода
лития и азота: сродство к электрону щелочного металла лития не просто больше, чем у азота, а отличается и по знаку: превращение Li Li– сопровождается выделением энергии, а превращение N N– требует затрат энергии.
Учитывая изложенное выше, сравнение металлических или неметаллических свойств элементов проще и обычно надежнее делать, исходя из их положения в периодической таблице.
Так, для элементов одного периода (радиусы которых меняется мало) с увеличением заряда ядра атомов увеличиваются неметаллические и уменьшаются металлические свойства (по этой причине каждый период начинается с металла и заканчивается неметаллом).
В группахметаллические свойства элементов увеличиваются с увеличением номера периода в главных подгруппах (вследствие увеличения r) и уменьшаются в побочных (вследствие увеличения зарядов ядер при малых изменениях радиуса).
Таким образом, с помощью периодической таблицы легко выделить элементы–металлы и элементы–неметаллы:
– все элементы s-семейства (кроме Н и Не) – металлы – это элементы главных подгрупп I и II групп; к металлам относятся также все, без исключений, элементы d-, f-семейств, т.е. все элементы побочных подгрупп;
– из элементов p-семейства (главные подгруппы III–VIII групп) к металлам относятся те, которые расположены ниже диагонали, проведенной через B – Si – As – Te – At. На этой диагонали и выше нее, в правом верхнем углу периодической таблицы, в главных подгруппах, расположены неметаллы (к ним же следует отнести и германий, Ge).
Пример: определить с помощью периодической таблицы, какие из заданных элементов относятся к металлам, а какие – к неметаллам; какой из металлов более металличен, а из неметаллов – более неметалличен: Ca, Cr, As, W, Br.
Решение: из заданных элементов относятся к металлам Са (как элемент II группы, s‑семейства), а также Cr и W (как элементы побочной подгруппы, d‑семейства); к неметаллам относятся As и Br, как элементы p‑семейства (см. «диагональ»). Далее, Ca, Cr, As, Br – элементы одного периода, следовательно, самый металличный из них – кальций, а самый неметалличный – бром; из Cr и W более металличен хром, т.к. в побочных подгруппах металлические свойства уменьшаются с увеличением заряда ядра. Таким образом, из заданных элементов наиболее металличным является кальций, а более неметалличным – бром.