Файл: 1. Элементарлы талдау а талданатын заттаы жеке компоненттерді анытайтын сапалы жне санды талдау дістері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 1541
Скачиваний: 1
СОДЕРЖАНИЕ
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
*С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
A) Сұйылтылған азот қышқылымен.
A) Сұйылтылған хлорсутек қышқылы.
A) Калийдің гексанитрокупраты(II).
B) Қорғасынның гексанитрокупраты(II).
C) Натрийдің гексанитрокупраты(II).
*D) Калий және қорғасынның гексанитрокупраты(II).
*A) Қаныққан натрий карбонаты ерітіндісімен өңдеу
A) Концентрлі аммиак ерітіндісі.
B) Қаныққан натрий карбонаты ерітіндісі.
A) Концентрлі аммиак ерітіндісі.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
201. АmBn жүйесі үшін тұнбаның түзілу жағдайы ( ):
A) КS мәні температураға тәуелді емес.
B) Температура жоғарылаған сайын Кsмәні артады.
222. Комплекстүзу реакциясы арқылы ерітіндіге нашар өтетін тұнба:
*A) Оствальдтың сұйылту заңына.
*A) Оствальдтың сұйылту заңына.
D) Тұнбаға түсіру кезіндегі ортаның рН мәнімен.
А) Массаларының қатынасы 1:10.
В) Көлемдерінің қатынасы 1:10.
*Е) Эквивалент мөлшерлерінің қатынасы 1:1.
*C) Индикатормен де, индикаторсыз да.
*A) Жұтылу спектрі - жұтылған жарықтың толқын ұзындығы.
A) Электромагнитті сәулеленудің табиғатын білу үшін.
*A) Жұмысшы электроды потенциалы – титрант көлемі.
*A) Жартылай толқын потенциалдардың айырымын арттыру үшін
B) Оптикалық жұтылу мен жұтылу қабатындағы толқын ұзындығыарасындағы сызықтық байланыс.
C) Оптикалық жұтылу мен жарық жұтылуындағы толқын ұзындығы арасындағы сызықтық байланыс.
D) Молярлық жұтылу мен толқын ұзындығы арасындағы сызықтық байланыс.
A) Тұрақты ток күшіндегі кулонометрия.
*A) Ток күшінің уақытқа көбейтіндісі.
B) Кернеудің уақытқа көбейтіндісі.
Гидролиз
121. Тұз иондарының сумен әрекеттесіп әлсіз электролит түзу нәтижесінде реакция ортасының өзгеруі:
A) Иондану.
B) Ассоциация.
C) Гидролиз.
D) Тотығу-тотықсыздану.
E)Электролиз.
122. Ортасы сілтілік болатын тұз ерітіндісінің [OH-] есептейтін қатынас :
A)
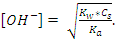
B)
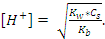
C)
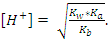
D)
E)
123. Ортасы қышқылдық болатын тұз ерітіндісінің [H+] есептейтін қатынас:
A)
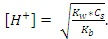
B)
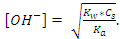
C)
D)
E)
124. Ортасы бейтарап болатын тұз ерітіндісінің [H+] есептейтін қатынас:
A)
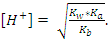
B)
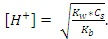
C)
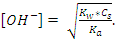
D)
E)
125. Гидроиз константасын белгілейді:
A) Ks
B) Ka
C) Kb
D) Kh
E) β.
126. Қайтымсыз гидролизденетін тұз реакциясының теңдеуі:
A) CaCI2 + H2C2O4 = CaC2O4 + 2HCI.
B) AI2S3 + 6H2O = AI(OH)3 +3H2S.
C) NaOH + HCI = NaCI + H2O.
D) Fe + 2HCI = FeCI2 + H2.
E) Na2CO3 + 2HCI = 2NaCI + CO2 + H2O.
127. Қайтымсыз гидролизденетін тұз реакциясының теңдеуі:
A) CaCI2 + H2C2O4 = CaC2O4 + 2HCI.
B) 2AICI3 + 3Na2CO3 + 3H
2O = 2AI(OH)3 +6NaCI + 3CO2.
C) NaOH + HCI = NaCI + H2O.
D) Fe + 2HCI = FeCI2 + H2.
E) Na2CO3 + 2HCI = 2NaCI + CO2 + H2O.
128. Катион бойынша гидролизденетін тұз:
A) КCI
B) К2 SO4
C) AICI3.
D) Na2SO4
E) NaNO3.
129. Анион бойынша гидролизденетін тұз:
A) КCI
B) NaAIO2
C) AICI3
D) Na2SO4.
E) NaNO3
130. Әлсіз қышқылдан және күшті негізден түзілген тұздардың гидролизін сипаттайтын дұрыс жағдай:
A) Тұздың анионы сумен әрекеттесіп әлсіз қышқылдың түзілуінен реакция ортасы рН > 7 болады.
B) Тұздың катионы сумен әрекеттесіп әлсіз негіздіңң түзілуінен реакция ортасы рН < 7 болады.
C) Тұздың катионы да, анионы да сумен әрекеттесіп әлсіз қышқыл және әлсіз негіз түзілуінен
реакция ортасы рН = 7 болады.
D) Реакция нәтижесінде әлсіз қышқыл түзіледі, рН = 7 орта.
E) Реакция нәтижесінде әлсіз негіз түзіледі, орта рН = 7 болады.
131. Әлсіз негізден және күшті қышқылдан түзілген тұздардың гидролизін сипаттайтын дұрыс жағдай:
A) Тұздың анионы сумен әрекеттесіп әлсіз қышқылдың түзілуінен реакция ортасы рН > 7 болады.
B) Тұздың катионы сумен әрекеттесіп әлсіз негіздіңң түзілуінен реакция ортасы рН < 7 болады.
C) Тұздың катионы да, анионы да сумен әрекеттесіп әлсіз қышқыл және әлсіз негіз түзілуінен
реакция ортасы рН = 7 болады.
D) Реакция нәтижесінде әлсіз қышқыл түзіледі, рН = 7 орта.
E) Реакция нәтижесінде әлсіз негіз түзіледі, орта рН = 7 болады.
132. Әлсіз негізден және әлсіз қышқылдан түзілген тұздардың гидролизін сипаттайтын дұрыс жағдай:
A) Тұздың анионы сумен әрекеттесіп әлсіз қышқылдың түзілуінен реакция ортасы рН > 7 болады.
B) Тұздың катионы сумен әрекеттесіп әлсіз негіздіңң түзілуінен реакция ортасы рН < 7 болады.
C) Тұздың катионы да, анионы да сумен әрекеттесіп әлсіз қышқыл және әлсіз негіз түзілуінен
реакция ортасы рН ≈ 7 болады.
D) Реакция нәтижесінде әлсіз қышқыл түзіледі, рН ≈ 7 .орта.
E) Реакция нәтижесінде әлсіз негіз түзіледі, орта рН ≈ 7 .болады.
133. теңдігімен есептейтін бинарлы тұздар тұрады:
A) Әлсіз қышқылдан және күшті негізден түзілген.
B) Әлсіз негізден және әлсіз қышқылдан түзілген.
C) Күшті негіз бен күшті қышқылдан түзілген.
D) Әлсіз негізден және күшті қышқылдан түзілген.
E) Қос тұздан түзілген.
134. теңдігімен есептейтін бинарлы тұздар тұрады:
A) Әлсіз қышқылдан және күшті негізден түзілген.
B) Әлсіз негізден және әлсіз қышқылдан түзілген.
C) Күшті негіз бен күшті қышқылдан түзілген.
D) Әлсіз негізден және күшті қышқылдан түзілген.
E) Қос тұздан түзілген.
135. Гидролизденгенде ерітінді ортасын
A) КCl.
B) NaNO3.
C) KCN.
D) CH3COONH4.
E) NH4 Cl.
136. Гидролизденгенде ерітінді ортасын
A) NaCl.
B) NaNO3.
C) KCN.
D) CH3COONH4.
D) NH4 Cl.
137. Гидролизденгенде ерітінді ортасын
A) NaCl.
B) NaNO3.
C) KCN.
D) CH3COONH4.
E) NH4Cl.
138. Алюминий хлориді тұзының гидролизін арттыру үшін қолданады:
A) Na2CO3.
B) NaNO3.
C) KCl.
D) K2SO4.
E) NaCl.
Буферлік ерітінділердегі тепе-теңдік
139. Буферлік жүйе:
A) Аз мөлшерде күшті қышқыл немесе сілті қосқанда, сұйылтқанда ортаның сутектік көрсеткішін өзгертпейтін жүйе.
B) Әлсіз негізден және оның әлсіз қышқылдан түзілген тұзы қоспасынан тұратын жүйе.
C) Әлсіз қышқылдан және оның әлсіз негізден қосылған тұзынан тұратын жүйе.
D) Кез келген қышқылдан және оның тұзынан тұратын жүйе.
E) Кез келген негiзден және оның тұзынан тұратын ерiтiндi.
140. Магний ионын натрий гидрофосфатымен анықтауда қолданылатын буферлік жүйе:
A) Na2HPO4 + NaH2PO4.
B) CH3COOH + CH3COONa.
C) HCOOH + HCOONa.
D) NH4OH + NH4Cl.
E) H2CO3 + NaHCO3.
141. 2BaCl2+ K2Cr2O7+ H2O= 2BaCrO4 + 2KCl +2HCl реакциясын жүргізу үшін қажетті буферлік жүйе:
A) Na2HPO4 + NaH2PO4.
B) CH3COOH + CH3COONa.
C) HCOOH + HCOONa.
D) NH4OH + NH4Cl.
E) H2CO3 + NaHCO3.
142. Қышқылдық буферлік жүйе:
A) Әлсіз қышқыл және оның әлсіз негізден түзілген тұз ерітінділерінің қоспасы.
B) Күшті негіз және оның әлсіз қышқылдан түзілген тұз ерітінділерінің қоспасы.
C) Күшті қышқыл және оның әлсіз негізден түзілген ерітінділерінің қоспасы.
D) Әлсіз қышқыл және оның күшті негізден түзілген тұз ерітінділерінің қоспасы.
E) Күшті қышқыл және оның күшті негізден түзілген тұз ерітінділерінің қоспасы.
143. Негіздік буфер жүйесі:
A) Күшті негіз және оның күшті қышқылдан түзілген тұз ерітінділерінің қоспасы.
B) Күшті қышқыл және оның әлсіз негізден түзілген тұз ерітінділерінің қоспасы.
C) Әлсіз негіз және оның әлсіз қышқылдан түзілген тұз ерітінділерінің қоспасы.
D) Әлсіз негіз және оның күшті қышқылдан түзілген тұз ерітінділерінің қоспасы.
E) Күшті негіз және оның әлсіз қышқылдан түзілген тұз ерітінділерінің қоспасы.
144. Ацетат буферінің қышқылмен өзара әрекеттесуінің молекулалық теңдеуі:
A) CH3COOH+ HCl →CH3COOCl+ H2O.
B) CH3COOH + HCl CH3COONa + NaCl.
C) CH3COONa+ HCl CH3COOH + NaCl.
D) CH3COONa + 2HCl CHCl2 COOH+ 2NaCl.
E) CH3COONa + HCl CH2Cl COOH + NaCl.
145. 0,01 моль/л сірке қышқылы (Ка = 1,8*10-5) және 0,01 моль/л натрий ацетаты ерітінділерінің
бірдей көлемдерін араластырған кезде түзілген ерітіндінің рН-ы:
A)1,00.
B) 2,00.
C) 3,00.
D) 4,75.
E) 9,25.
146. 0,1 моль/л сірке қышқылы (Ка = 1,8*10-5) және 0,01 моль/л натрий ацетаты ерітінділерінің
бірдей көлемдерін араластырған түзілген ерітіндінің рН-ы:
A) 1,25.
B) 2,75.
C) 5,75.
D) 4,75.
E) 3,75.
147. Қышқылдық буфер ерітінділерінің рН мәнін есептеу үшін қажет шамалар:
A) ақ-л және СНAn/CKtAn.
B) Kқ-л және СНAn/CKtAn.
C) Kқ-л және СKtAn/CНAn.
D) h және СНAn/CKtAn.
E) h гидролиз дәрежесі және a.
148. Негіздік буферлік жүйе ерітіндісінің рН –ын есептейтін Гендерсон-Гассельбах теңдеуі:
A) pH = -lgCH+.
+B) +lg
C) pH= 14- pOH.
D) pH= - .
E) pH= - - .
149. Көлемі 100 см3, 0,2 моль/л CН3COOH (K(CН3COOH)=10-5) ерітіндісінің көлемі100 см3,
0,2моль /л CН3COONa ерітіндісін қосқанда түзілген ерітіндісінің рН-ы:
A) 1.
B) 2.
C) 3.
D) 4.
+E) 5.
150. С н= 0,05 моль/л , Ст = 0,5 моль/л , Kн= 10-7 тең буфер жүйесінің pH-ның мәні :
A) 2.
B) 4.
+C) 6.
D) 8.
E) 10.
215. Сулы ерітіндідегі комплексті қосылыстың иондануы:
A) Күшті электролиттер сияқты толық ионданады.
B) Алдымен әлсіз электролиттер сияқты ионданады, түзілген комплексті ион күшті электролиттер сияқты толық ионданады.
C) Әлсіз электролиттер сияқты ионданады.
+D) Алдымен күшті электролиттер сияқты ионданады, содан соң түзілген комплексті ион әлсіз электролиттер сияқты сатыланып ионданады.
E) Бірінші және екінші сатысында да әлсіз электролиттер сияқты
ионданады.
216. Монодентатты комплексті қосылыс:
+A) K3[Fe(CN)6].
B) Na2[Fe(SO4)2 ].
C) K3[Fe(C2O4)3].
D) Na3[Fe(PO4)3].
E) [Fe(NH3)CO3]Cl.
217. Полидентатты комплексті қосылыс:
A) K3[Fe(CN)6].
+B) Na2[Fe(SO4)2 ].
C) K4[Fe(CN)6].
D) Na3[Co(NO2)6].
E) [Ag(NH3)2]Cl.
218. Кобальттың тотығу дәрежесі +3-ке тең [Co(NH3)4(CN)2]x комплексті ионының заряды:
A) 0.
+B) +.
C) 2+.
D) -.
E) 2-.
219. Комплекстүзушінің тотығу дәрежесі +4-ке тең [Pt (NH3)4(CN)4] x комплексті ионының заряды:
+A) 0.
B) 1+.
C) 2+.
D) 1-.
E) 2-.
220. [Co(NH3)5Br]SO4 комплексті қосылысындағы комплекстүзуші ионның тотығу дәрежесі:
A) +2.
B) -2.
+C) +3.
D) -5.
E) -3.
221. K3[Fe(C2O4)3]қосылысындағы комплексіндегі комплекс түзушісінің кординациялық саны:
A) 0.
B) 2.
C) 3.
D) 5.
+E) 6.
222. [Cu(NH3)4 ]SO4 комплексіндегі комплекс түзушісінің кординациялық саны және лиганда дентаттылығы :
A) 2; 1.
B) 2; 2.
C) 4; 4.
D) 3; 3.
+E) 4; 1.
223. Cd2+ ионының мөлшері көп болатын комплексті ион :
A) Kт-сыз ([Cd(CN)4]2-) = 7,8 ·10-18.
B) Kт-сыз ([Cd(CN)4]2-) = 2,8 ·10-7.
C) Kт-сыз ([CdCl4]2-) = 2,0 ·10-2.
D) Kт-сыз ([CdI4]2-) = 3,0 ·10-6.
E) Kт-сыз ([Cd(N2H4)4]2-) = 1,3 ·10-4.
224. Орталық ион – комплекстүзушісінің айналасына жиналған лигандалар саны :
A) Ішкі сфера заряды.
B) Комплексті ионының заряды.
C) Координациялық сан.
D) Лиганда заряды.
E) Комплекстүзуші заряды.
225. Тұрақсыздық константасының мәні неғұрлым жоғары болса, соғұрлым:
A) Кешенді қосылыс тұрақсыз.
B) Кешенді қосылыс тұрақты.
C) Реакция тез жүреді.
D) Процесс баяу өтеді.
E) Реакцияға қатыспайды.
226. Комплексті қосылыстың тұрақтылық константасын белгілейді:
A) Ks