ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.12.2023
Просмотров: 305
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
По рис.2.9(а) видно, что температуры замерзания (кристаллизации) растворов
∆Тз = Тз(о) – Тз = Ккb, (2.8)
где ∆Тз – уменьшение температуры замерзания раствора, Кк – криоскопическая постоянная, характеризующая только растворитель (для воды Кк = 1,86кг·К/моль). Уравнение (2.8) в настоящее время также выведено теоретически, а криоскопическая постоянная в нем имеет следующее значение:
 (2.9)
(2.9)где
Под температурой замерзания раствора в (2.8) подразумевается температура начала замерзания растворителя. Например, в случае водного раствора вначале вымораживается чистый лед, а концентрация остающегося при этом раствора повышается, следовательно, температура замерзания его понижается. Так, процесс вымораживания ненасыщенного раствора хлорида натрия продолжается до температуры –21,1 оС, когда образуется эвтектическая смесь, и из насыщенного раствора одновременно кристаллизуются вода и соль.
Иногда выражения (2.6) и (2.8) называют вторым законом Рауля: повышение температуры кипения и понижение температуры замерзания растворов нелетучих веществ пропорциональны моляльной концентрации растворенного вещества.
К колигативным свойствам растворов относится также осмотическое давление. Суть его в следующем. Некоторые материалы (керамика, кожа, пергамент) обладают свойством полупроницаемости. Они чаще всего проницаемы для растворителей и непроницаемы для растворенных веществ. Когда два раствора (или раствор и растворитель) разделены полупроницаемой пленкой, то растворитель самопроизвольно переходит из более разбавленного раствора в более концентрированный. Это явление названо осмосом. Движущим фактором осмоса является энтропийный фактор – стремление растворителя к выравниванию значения химического потенциала по обе стороны полупроницаемой пленки.

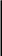 а) б) в)
а) б) в)р

 4
4




 2 2 1 2 5
2 2 1 2 5 1
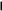
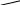

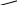 3 3 3
3 3 3Рис. 2.10. Осмоc: а – начало процесса; б – конец процесса;
в – к столбцу раствора приложено давление р, равное осмотиче-
скому давлению; 1 – разбавленный раствор, 2 – концентри-
рованный раствор, 3 – полупроницаемая мембрана,
4 – поршень, 5 – чистый растворитель
На рис. 2.10 показано, как в исходном состоянии в U-образной трубке, разделенной полупроницаемой перегородкой 3 приведены в контакт два раствора: концентрированный (с2) и разбавленный (с1), содержащие одно и то же вещество. В этом случае растворитель из правого колена начнет диффундировать через мембрану в левое колено. Осмос будет продолжаться до тех пор, пока избыточное давление, приложенное к левому колену столбцом раствора высотой h или внешним давлением р, не остановит его:
р = ρgh, (2.10)
где р – внешнее давление, приложенное к поршню 4 (в); ρ – плотность раствора; g – ускорение свободного падения; h – высота столбца раствора над уровнем правого колена.
В правом колене U-образной трубки может находиться чистый растворитель. Для того чтобы остановить осмос из чистого растворителя в раствор, к раствору надо приложить давление, которое называется осмотическим давлением этого раствора. Осмотическое давление связано с концентрацией раствора уравнением, названным в честь его открывателя уравнением Вант-Гоффа:
π = сRT, (2.11)
где π – осмотическое давление; с – молярная концентрация раствора.
Если формулу (2.11) применить к рис 2.10, то она примет следующий вид:
∆π = ∆сRT,
где ∆π – разность осмотических давлений растворов 1 и 2, ∆π = π2 – π1 при ∆с = с2 – с1.
Полупроницаемой перегородкой могут быть разделены два раствора, обладающие одинаковым осмотическим давлением. В этом случае одностороннего проникновения растворителя через перегородку не будет. Такие растворы называются изотоническими. В них может быть растворенным одно и то же вещество или разные вещества. Раствор, обладающий меньшим осмотическим давлением по сравнению с более концентрированным раствором, называется гипотоническим, а более концентрированный раствор называется гипертоническим.
Осмос играет очень важную роль в биологических системах. Так, красные кровяные тельца – эритроциты покрыты полупроницаемой мембраной, и поэтому при их попадании в гипертонический раствор (по отношению к внутриклеточной жидкости) из них вытекает вода. В результате красные кровяные тельца сморщиваются и погибают (этот процесс называется кренацией). Если красные кровяные тельца попадают в гипотонический раствор по сравнению с их внутриклеточной жидкостью, то в них поступает вода. Это приводит к разрыву кровяных телец (такой процесс называется гемолизом).
Можно привести много примеров осмоса. Так, для сохранения продуктов их солят или засыпают сахаром. Бактерии при этом погибают от сморщивания, т.к. концентрация их внутриклеточной жидкости меньше, чем концентрация рассола или сиропа. Стенки бактерий являются мембранами, сквозь которые благодаря осмосу в бактерии поступает вода и питательные вещества. Осмотическое давление морской воды составляет 23 атм. Это означает, что за счет осмотического давления морской воды может удерживаться столб морской воды высотой 238 м. Если бы удалось создать полупроницаемые мембраны, способные выдерживать такое давление, то на берегах морей при впадении в них рек можно было бы построить мощные гидроэлектростанции.
Если измерить любое из коллигативных свойств раствора, то можно вычислить молярную массу растворенного вещества (Мв). Например, по ∆Ткип:

откуда получим:

где mв – масса растворенного вещества в г, mo – масса растворителя в кг.
В растворах электролитов количество частиц (ионов и молекул) растворенного вещества увеличивается за счет диссоциации. Следовательно, все значения коллигативных свойств возрастают. Поэтому в законы Рауля и Вант-Гоффа вводится поправочный коэффициент, который назван изотоническим коэффициентом i. Он показывает, во сколько раз повышается количество частиц в растворе электролита вследствие диссоциации:
i = 1 + , (2.12)
где - степень диссоциации; - число ионов, образующихся из одной формулярной единицы или молекулы. Тогда для растворов электролитов выполнятся следующие уравнения:
р = р о - р = i р о Xв,
Tкип = i Кэ b, (2.13)
Tз = i Кк b,
= i с R T.
Например, повышение температуры кипения для раствора хлорида натрия примерно в два раза превышает эту же величину для раствора сахара с той же моляльной концентрацией, т.к. соль распадается на два иона. Вместе с тем, экспериментальное значение , которое можно определить методами эбуллиоскопии, криоскопии, осмометрии (вначале экспериментально определяется ∆р или ∆Тз или ∆Ткип , затем i по (2.13), а затем по (2.12)) иногда получается меньше единицы. В связи с этим для растворов сильных электролитов было введено понятие кажущейся степени диссоциации. В них существует некоторое подобие структуры вследствие упорядоченности в расположении ионов различного знака. Кроме того, гидратированные катионы и анионы могут существовать в виде ассоциациатов. Такие ассоциаты получили название ионных пар. Раствор, таким образом, ведет себя так, как будто в нем ионов меньше, чем на самом деле. При повышении концентрации кажущаяся степень диссоциации уменьшается, так как межионное взаимодействие увеличивается.
Другим способом учета влияния концентрации ионов на коллигативные свойства растворов является введение коэффициентов активности ионов. Прочность ионных пар определяется всеми присутствующими ионами в растворе. Поэтому коэффициент активности зависит от некоторой аддитивной величины, называемой ионной силой раствора (I), которая равна полусумме произведений концентраций всех ионов на квадрат их заряда:
I = ci zi2 . (2.14)
Эмпирическим путем получено уравнение для расчета коэффициента активности ионов:
lg f = - 0,5 z2
. (2.15)
2.3.3. Равновесие пар - жидкий раствор летучих веществ
Если имеется раствор двух летучих жидкостей (А+В), то пар будет содержать оба компонента. Закон Рауля можно записать как для растворителя, так и для растворенного вещества. Общее давление пара над раствором по закону Дальтона будет складываться из парциальных давлений компонентов А и В:
p = pо(А)XА + ро(В)ХВ. (2.16)
В соответствии с правилом фаз в равновесном состоянии у системы в таком случае число степеней свободы равно: С= 2+2-2=2. При заданных значениях Т и р в равновесии будут находятся жидкость и пар фиксированных составов. Чтобы не пользоваться трехмерными диаграммами, строят двумерные диаграммы состояния либо при р=const, либо при T=const, котрые являются зеркальным изображением друг друга. Такие диаграммы представляют собой по форме "лепестки" или "рыбки", на которых различают кривые жидкости и кривые пара (например, соответственно 2,5 и 3,4 на рис. 2.11). Точки кривой жидкости 2, характеризуют составы кипящих жидкостей и температуры их кипения при р=const. Точки кривой пара 3 характеризуют составы насыщенного пара и температуры их конденсации при р=const.
По рис. 2.11 видно, что температура кипения компонента В больше, чем температура кипения компонента А ( Т(В)>Т(А) ), т.е. компонент А более летуч, и поэтому он имеет более высокое давление насыщенного пара при Т = const (диаграмма б). Поля диаграмм между кривыми 2 и 3 и между кривыми 4 и 5 соответствуют двухфазным состояниям системы, когда в равновесии находятся пар и жидкость (как и вдоль всех кривых) (С=1). Области, лежащие под и над "лепестками", соответствуют однофазным состояниям системы (С=2). Если, например, нагревать раствор состава 1, то давление его насыщенного пара будет повышаться. Когда оно достигнет значения р=const, жидкость закипит. Температура кипения Т1 определяется точкой пересечения вертикали с кривой жидкости 2. При этом равновесный состав пара будет отличаться от состава жидкости. Его можно определить, проведя горизонтальную линию (линию связи) до пересечения ее с кривой пара 3. Пар будет обогащен легкокипящим компонентом А (точка К). Если проводить охлаждение пара состава 1 из точки 6 то начало конденсации будет соответствовать температуре Т2, а конденсирующаяся жидкость будет обогащена относительно пара высококипящим компонентом В (точка L). Таким образом при охлаждении пара любого состава двухкомпонентной системы (А+В) можно получить две точки – температуру начала конденсации и температуру ее завершения.