ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.12.2023
Просмотров: 286
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
2NO + O2 = 2NO2 .
В параллельныхреакциях, например, исходное вещество одновременно расходуется в двух различных реакциях:
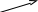 k1 В
k1 В
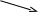 А
АM
k2
Тогда скорость суммарной реакции по отношению к веществу А будет складываться по двум скоростям:
vA = - dc(А)/d = (k1 + k2) c(А).
Скорости получения продуктов:
dc(В)/d = k1c(А) ; dc(М)/d = k2c(А).
После интегрирования и преобразования получим, что концентрации продуктов пропорциональны константам скоростей:
c(В)/c(М) = k1 / k2 .
Полученное соотношение используется для изучения кинетики быстрых реакций. Если образование вещества В происходит очень быстро, а кинетику образования М можно изучить в ходе независимых экспериментов, то по соотношению концентраций продуктов можно установить кинетические параметры первой конкурирующей реакции.
На рис. 3.6 показано изменение концентраций веществ для случая k1 k2.
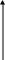 с
с
 c(В) c(М)
c(В) c(М)
c(А)
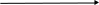 τ
τРис. 3.6. Зависимость концентраций реагента (А) и продуктов (В и М) в реакционной системе от времени
Низкая селективность реакций характерна для органических веществ. Например, при хлорировании метана одновременно получаются CH3Cl, CH2Cl2, CHCl3, CCl4. При нитровании фенола образуются орто-нитрофенол и пара-нитрофенол.
Сопряженными называются такие реакции, которые не могут протекать друг без друга, то есть когда одна самопроизвольная реакция вызывает протекание другой реакции. Например, хромовая кислота не окисляет иодоводород в отсутствии оксида железаII:

 H2CrO4 + 2FeO
H2CrO4 + 2FeO Cr2O3 + Fe2O3
Cr2O3 + Fe2O3
+ 4H2O + 2I2 .
 H2CrO4 + 4HI
H2CrO4 + 4HI Коррозия металла невозможна без наличия окислителя в окружающей среде:

 2Zn - 4e
2Zn - 4e 4Zn(OH)2 .
4Zn(OH)2 . O2 + 2H2O + 4e
O2 + 2H2O + 4eПринцип независимости реакций неприменим к сопряженным реакциям.
В цепных реакциях на каждом этапе ее протекания возникает активная частица (радикал), которая вызывает цепь дальнейших превращений. Активными являются частицы с нескомпенсированной валентностью, то есть имеющие неспаренные электроны:
Каждая цепная реакция включает три основные стадии: зарождение цепи, продолжение, обрыв. Зарождение цепи обычно начинается с разрыва наименее прочной молекулы, который происходит с низкой энергией активации. Первая стадия чаще всего осуществляется в результате инициирования извне: под действием высокой температуры, излучения, добавления специальных веществ. Например, при облучении газообразного хлора синим светом происходит диссоциация его молекул на атомы:
Химическими инициаторами могут выступать вещества, которые легко распадаются на свободные радикалы, например, органические перекиси и хлористый нитрозил:
Стадия продолжения цепи состоит из большого числа повторяющихся элементарных реакций взаимодействия активных частиц с исходными веществами. Так, схеме неразветвленной цепи соответствует процесс хлорирования этилена:
Cl2 + C2H4 = C2H4Cl2 ;
Видно, что радикал хлора воспроизводится, и процесс повторяется множество раз.
Схема разветвленной цепи предусматривает увеличение числа активных частиц на отдельных стадиях:
-











и так далее.
Примером такой реакции является горение водорода в кислороде. В простейшем виде реакцию можно представить в виде схемы:
Цепь I Цепь II
1.
2.
1.
2.
Цепь I состоит из чередующихся стадий 1, 2, 1, 2 …, цепь II – из стадий 3, 2, 1, 3, 2, 1 …. При этом только в одной стадии (второй) образуется молекула продукта (вода) и одна активная частица (
Обрыв цепной реакции происходит в результате двойного столкновения радикалов со стенкой сосуда или в результате тройного столкновения двух радикалов с некоторой частицей М, которая забирает на себя избыточную энергию, выделяющуюся при образовании химической связи. При двойном столкновении радикалов между собой цепь не обрывается, так как образовавшаяся молекула имеет большой запас энергии, является неустойчивой и вновь распадается на радикалы. В роли частиц М могут выступать молекулы, имеющие прочные химические связи, и атомы благородных газов, например: N2, CO, Ar, Kr и т.д.. При этом молекулы М приобретают возбужденное состояние М*, но их распада не происходит.
Существует множество реакций с нетермической активацией реагирующих частиц. Реакции, протекающие под воздействием быстрых элементарных частиц, являются предметом изучения радиационной химии, а протекающие в плазме электрического разряда - плазмохимии. Если реакция происходит при поглощении квантов электромагнитного излучения, в том числе квантов света, то реакция называется фотохимической. Характерными особенностями реакций с нетермической активацией являются:
-
независимость скорости реакций от температуры; -
возникновение значительно большего количества активных частиц по сравнению с реакциями с термической активацией.
Понятие свет включает видимый спектр излучения и ультрафиолетовую область. Первый закон фотохимии Гротгуса-Дрепера гласит: только поглощаемое средой световое излучение может произвести ее химическое изменение. Отсюда следует, что вещества, реагирующие под воздействием видимого спектра излучения, окрашены (хлорофилл, хлор, оксид азота NO2 и т.д.). Многие системы, однако, поглощают световую энергию без каких-либо химических изменений.
Второй закон фотохимии сформулировал Эйнштейн: каждый поглощенный квант света в первичном акте способен активировать только одну молекулу. Отсюда следует, что 1 моль вещества поглощает число Авогадро квантов:
Е(М) = NAh = NAhс/ ,
где - частота излучения; h - постоянная Планка; - длина волны излучения; с - скорость света. Чем выше частота (чем меньше длина волны), тем химически активнее излучение. В области видимого спектра наименьшей химической активностью обладают красные, а наибольшей - фиолетовые лучи.
При поглощении кванта света молекула переходит в возбужденное состояние:
М + h = М*.
Энергия электромагнитного излучения трансформируется в энергию движения электронов примерно за 10-15 с. После этого могут происходить следующие превращения:
-
переход в изомерную молекулу, например:
триплет синглет 1 синглет 2;
-
распад на радикалы Cl2* = 2 ;
; -
реакция с другими молекулами в системе; -
ионизация ::O* = NO+ + e .
::O* = NO+ + e .
Основной количественной характеристикой фотохимической реакции является квантовый выход , который равен следующему соотношению:
Согласно закону Эйнштейна квантовый выход в истинно фотохимической реакции равен 1. Однако на самом деле может быть и больше, и меньше 1. Если 1, то после поглощения кванта молекула может не успеть прореагировать и отдать избыточную энергию другой молекуле при столкновении; либо молекула может испустить квант света (свечение вещества вследствие испускания энергии возбуждения называется люминесценцией). Квантовый выход может составить несколько единиц, так как вслед за фотохимической реакцией могут идти темновые реакции без участия квантов света. Например, в стратосфере существует озоновый слой, который защищает Землю от губительного ультрафиолетового излучения, и в этом слое протекают следующие реакции:
1) О2 + h (дальний ультрафиолет) = 2О - фотохимическая стадия;
2О2 + 2О + М = 2О3 + М* - темновая стадия.
3О2 + h = 2О3
2) О3 + h (ближний ультрафиолет) = О2 + О - фотохимическая стадия;
О + О3 = 2О2 - темновая стадия.
2О3 + h = 3О2
В обоих случаях на две молекулы озона приходится один квант света ().
Если 1 и достигает 106, то протекает цепная реакция.
Скорость фотохимической реакции пропорциональна молярной концентрации вещества, поглощающего свет: v = kc.
3.5. КАТАЛИЗ
Катализатором называют вещество, увеличивающее скорость химической реакции, но не входящее в состав конечных продуктов.