ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.12.2023
Просмотров: 291
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Если через электрод начинает протекать ток, равновесие нарушается, и потенциал отклоняется от равновесного значения. При поступлении электронов из внешней цепи по принципу Ле Шателье система должна отреагировать так, чтобы израсходовать эти избыточные электроны. На электроде начинают преимущественно протекать катодные реакции: встраивание катионов металла в кристаллическую решетку или восстановление окислителей раствора. Электрохимические реакции - это многостадийные процессы. Так, например, разряд катионов металла в простейшем случае протекает через следующие стадии:
-
диффузия гидратированных ионов из глубины раствора к двойному электрическому слою; -
встраивание ионов в плотную часть двойного слоя с частичной потерей гидратных оболочек; -
полная дегидратация, образование адсорбированных атомов; -
миграция атомов по поверхности и встраивание в кристаллическую решетку.
Скорость процесса в целом определяется самой медленной стадией, но каждая из них протекает значительно медленнее, чем двигаются электроны по металлическому проводнику. Поэтому при протекании катодной реакции потенциал электрода неизбежно в той или иной мере отклоняется в отрицательную область. Данное явление называется электродной поляризацией, а зависимость потенциала электрода от протекающего тока называется поляризационной кривой. Чем больше тормозится электродный процесс, тем больше поляризация. В качестве примера на рис. 4.2 представлены кривые разряда катионов меди из растворов простых солей (кривая 1) и прочных комплексных катионов (кривая 2). В последнем случае процесс восстановления катионов меди сопровождается предварительным разрушением комплексных ионов, и поэтому замедлен.
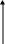
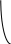
 I
I2 1

E2 Е1 Е
Рис. 4.2. Поляризационные кривые при разряде ионов
Cu2+ (1) и [Cu(CN)4]2 (2)
Когда электроны уходят во внешнюю цепь, то по принципу Ле Шателье на электроде начинаются анодные процессы: переход катионов металла в раствор и окисление восстановителей раствора, то есть процессы, которые позволяют восполнить убыль электронов. При этом потенциал анода неизбежно отклоняется в положительную область, так как электрохимические процессы заторможены по сравнению с движением электронов во внешней цепи.
4.2. ЗАВИСИМОСТЬ РАВНОВЕСНЫХ ПОТЕНЦИАЛОВ
ОТ КОНЦЕНТРАЦИИ КАТИОНОВ В РАСТВОРЕ.
УРАВНЕНИЕ НЕРНСТА
Гальванический элемент - это система из двух электродов, позволяющая преобразовать химическую энергию в электрическую. Рассмотрим элемент, составленный из цинкового электрода, опущенного в раствор собственной соли и стандартного водородного электрода
Zn ZnSO4 H+ H2(Pt). При замыкании внешней цепи на цинке идет анодный, а на водородном электроде - катодный процесс, и в системе протекает ток:
(А): Zn - 2e = Zn2+ ; (4.1)
 (K): 2H+ + 2e = H2 ;
(K): 2H+ + 2e = H2 ;суммарная реакция: 2H+ + Zn = H2 + Zn2+ .
Если в реакции провзаимодействует по два моля эквивалентов реагентов, то выделится энергия в виде свободной энергии Гиббса ∆Gр. При проведении процесса обратимо (бесконечно медленно и без потерь энергии) от химической системы можно получить энергию - ∆Gр в виде электрической энергии перемещения электронов во внешней электрической цепи, которая окажется равной произведению электродвижущей силы гальванического элемента Е (э.д.с.) на переносимый заряд Q (Q = nF, где n - число молей электронов, в данном случае 2, а F - заряд одного моля электронов, равный числу Фарадея: F = NA e = 96485 Кл/моль):
-G = nFE . (4.2)
Очевидно, что ток в цепи должен быть бесконечно малым по величине. Из соотношения (4.2) следует, что изменение свободной энергии химической системы может служить мерой э.д.с. гальванического элемента. И наоборот, измерением э.д.с. гальванического элемента можно определить G протекающей в нем реакции. В электрохимии принято электродные потенциалы относить к реакциям восстановления металлов электродов. Поэтому суммарную реакцию (4.1) представим в виде восстановления катионов Zn2+ и по уравнению (4.2) выразим зависимость цинкового электродного потенциала от а(Zn2+):
Zn2+ + Н2 ⇄Zn + 2Н+
G = (Zn) + 2 (H+) ( Zn 2+) ( Н2 ) .
С учетом (Zn) = (Zn); (H2) = (H2); (Н+) = (Н+):
G = ( Zn) + 2 (H+) (Н2) (Zn2+) - RT ln a(Zn2+) ;
G = G - RT ln a(Zn2+).
С учетом (4.2) получим:
- 2FE = - 2 FEo – RT ln a (Zn2+),
откуда
Е = Е + (RT/2F) ln a(Zn2+). (4.3)
Электродвижущая сила рассмотренного элемента принимается равной равновесному потенциалу цинкового электрода по водородной шкале. Стандартная электродвижущая сила Е, называемая
стандартным потенциалом цинка, равна Е при активности ионов цинка в растворе 1 моль/л. Величина Е характеризует природу металла. Второе слагаемое в уравнении (4.3) учитывает зависимость равновесного потенциала от концентрации ионов в растворе. Соотношение (4.3) называется уравнением Нернста. Подставив численные значения констант, Т=298 К и перейдя к десятичным логарифмам, окончательно получим уравнение Нернста в том виде, которым обычно пользуются в расчетах для электродов типа Ме Меn+:
Е = Е + (0,059/n) lg a(Меn+), В . (4.4)
Аналогично рассуждая, можно получить уравнение Нернста для любой окислительно- восстановительной системы:
Е = Е + (0,059/n) lg К , (4.5)
где К - константа равновесия электродной реакции, равная отношению действующих масс, относящихся к окисленной форме вещества, к действующим массам, относящимся к восстановленной форме. Рассмотрим применение уравнения (4.5) к некоторым системам.
Потенциал водородного электрода (Pt)H2H+ зависит от парциального давления водорода и концентрации его ионов в растворе:
2H+ + 2e = H2 ;
окисленная восстановленная
форма форма
при Е=0 Е = (0,059/2) lg а2(H+)/p(H2) ;
если p(H2) = 1 атм , то Е = (0,059/1) lg а(H+) ;
или: Е = 0,059 рН , В. (4.6)
Потенциал - определяющими ионами в растворе для кислородного электрода (Pt)О2ОH являются гидроксильные ионы, а вода находится в большом избытке, поэтому не является действующей массой:
О2 + 2Н2О + 4е = 4ОН ,
окисленная восстановленная
форма форма
Е = Е + (0,059/4) lg p(О2)/a4(ОН) .
Принимая давление кислорода 1 атм, а также учитывая ионное произведение воды Кв = а(H+) а(ОН) = 1014, после преобразований окончательно получим:
Е = 1,23 0,059 рН , В . (4.7)
Рассмотрим зависимость редокси-потенциала от концентрации ионов в окислительно-восстановительной системе:
ClO3 + 6H+ + 6е = Cl + 3H2O ; Е = + 1,45 В.
окисленная восстановленная
форма форма
Величина стандартного потенциала указана относительно стандартного водородного электрода при активности всех ионов в растворе 1 моль/л. Запишем уравнение Нернста, принимая во внимание, что активность ионов водорода входит в состав действующих масс окисленной формы:
Е = 1,45 + (0,059/6) lg а(ClO3)а6(H+)/a(Cl) .
Из полученного уравнения видно, что окислительная способность хлорат-иона в значительной степени зависит от рН среды.
ЛЕКЦИЯ 15 4.3. ПОТЕНЦИАЛ КОРРОЗИИ
Во многих случаях на поверхности металла одновременно происходит его окисление и восстановление какого-либо окислителя. Если опустить активный металл (например, цинк, магний, железо) в раствор соляной или разбавленной серной кислоты, то при этом образуется соль металла и выделится водород. Пусть ЕМе - это равновесный потенциал металла, который должен был бы установиться в растворе кислоты (рис. 4.3).
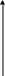

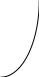 I
I2 1
 Iк
Iк
Iк

ЕМе Ек ЕН2 Е
Рис.4.3. Поляризационная диаграмма окисления металла катионами водорода
Тогда анодная кривая 1 выразит скорость анодного процесса окисления металла в зависимости от сдвига потенциала в положительную сторону от равновесного значения при оттоке электронов с металла во внешнюю цепь. Равновесный потенциал водородного электрода при определенном рН обозначим ЕН2. Катодная кривая 2 выразит тогда зависимость между сдвигом потенциала в отрицательную сторону и скоростью восстановления ионов водорода при подводе электронов из внешней цепи.
Очевидно, что потенциал ЕМе не отвечает равновесию ионов водорода в растворе (они находятся в равновесии с электродом только при потенциале ЕН2). В этом случае должно происходить восстановление водорода 2Н+ + 2е = Н2 со скоростью Iк. Так как электроны уходят с поверхности, потенциал металла сместится в положительную сторону, но при этом должен начаться процесс окисления Ме Меn+ + ne. Скорость восстановления ионов водорода уменьшится. Смещение потенциала будет происходить до того момента, пока число электронов, отнимаемых от металла ионами водорода в единицу времени, не будет равно числу избыточных электронов, накапливаемых за счет ухода катионов металла в раствор. Равенство скоростей окисления и восстановления наступает при потенциале Е
к, который называют стационарным, компромиссным потенциалом или потенциалом коррозии. Рассчитать его нельзя, можно только измерить экспериментально в том случае, когда концентрация ионов в растворе остается неизменной. Величина Iк носит название тока коррозии.
4.4. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Рассмотрим работу гальванического элемента, составленного из двух металлических электродов, опущенных в растворы их солей (элемент по типу Даниэля - Якоби), например:
 е
е



Zn ZnSO4 FeSO4 Fe +.
Если внешняя цепь разомкнута, на каждом электроде устанавливается равновесие:
 1 3
1 3


 Zn Zn2+ + 2e Fe Fe2+ + 2e
Zn Zn2+ + 2e Fe Fe2+ + 2e
 2 4
2 4
На цинковом электроде протекают две сопряженные реакции 1 и 2, а на железном - реакции 3 и 4. Равновесный потенциал цинка более отрицателен, чем равновесный потенциал железа (ЕZn2+/Zn = 0,76 B; EFe2+/Fe = 0,44 B). Следовательно, при равновесиях большее количество ионов цинка перейдет в раствор, и на цинке будет находиться больше электронов, чем на железе. При замыкании внешней цепи электроны начнут перетекать от цинка к железу. Равновесия на электродах нарушатся. По принципу Ле Шателье реакции 1 и 4 ускорятся, а реакции 2 и 3 замедлятся. В результате на цинковом электроде будет происходить анодный процесс окисления:
А: Zn → Zn2+ + 2e ,
а на железном электроде будет происходить восстановление ионов железа, то есть катодный процесс:
К: Fe2+ + 2e → Fe .
Таким образом, можно сделать два вывода:
-
в гальванической паре двух металлов всегда окисляется металл, потенциал которого более отрицателен; -
металл с более отрицательным потенциалом является поставщиком электронов во внешнюю цепь, поэтому в гальваническом элементе анод имеет знак минус.