Файл: Спецификация суммативного оценивания за четверть по предмету Химия.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 344
Скачиваний: 6
СОДЕРЖАНИЕ
Правила проведения суммативного оценивания
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 1 ЧЕТВЕРТЬ
Структура суммативного оценивания
Характеристика заданий суммативного оценивания за 1 четверть
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 2 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 2 четверть
Структура суммативного оценивания
Характеристика заданий суммативного оценивания за 2 четверть
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 3 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 3 четверть Продолжительность – 40 минут
Структура суммативного оценивания
Характеристика заданий суммативного оценивания за 3 четверть
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 4 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 4 четверть Продолжительность – 40 минут
Структура суммативного оценивания
Характеристика заданий суммативного оценивания за 4 четверть
-
Модерация и выставление баллов
Все учителя используют одинаковую схему выставления баллов. В процессе модерации необходимо проверять образцы работ с выставленными баллами для того, чтобы не допускать отклонения от единой схемы выставления баллов.
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 1 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 1 четверть Продолжительность – 40 минут
Количество баллов – 30
Типы заданий:
МВО – задания с множественным выбором ответов;
КО – задания, требующие краткого ответа;
РО – задания, требующие развернутого ответа.
Структура суммативного оценивания
Данный вариант состоит из 9 заданий, включающих задания с множественным выбором ответов, с кратким и развёрнутым ответами.
В вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения.
В вопросах, требующих развёрнутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Задание может содержать несколько структурных частей/подвопросов.
Характеристика заданий суммативного оценивания за 1 четверть
| Раздел | Проверяемые цели | Уровень мыслительны х навыков | Кол. заданий * | № задания * | Тип задания * | Время на выполнение , мин* | Балл* | Балл за раздел |
| 10.1A Строени е атома | 10.1.2.3 объяснять природу радиоактивности и применение радиоактивных изотопов; | Применение | 1 | 3 | КО | 4 | 3 | 7 |
| 10.1.2.5 составлять уравнения ядерных реакций; | Применение | 1 | 4 | КО | 3 | 2 | ||
| 10.1.3.3 различать формы s, p, d, f орбиталей; | Знание и понимание | 1 | 5 | КО | 3 | 2 | ||
| 10.1.3.4 составлять электронные конфигурации первых 36 химических элементов; | Применение | |||||||
| 10.1В Периоди чность изменен ий свойств элементо в и их соединен ий | 10.2.1.4 прогнозировать свойства химических элементов и их соединений по положению в периодической системе. | Навыки высокого порядка | 1 | 9 | РО | 6 | 5 | 5 |
| 10.1C Химическ ая связь | 10.1.4.2 объяснять образование двойных и тройных связей; | Применение | 1 | 2 | МВО | 1 | 1 | 12 |
| 10.1.4.4 объяснять различие видов гибридизации; | ||||||||
| 10.1.4.11 объяснять природу металлической связи и ее влияние на физические свойства металлов; | Применение | 1 | 6 | КО | 4 | 5 | ||
| 10.1.4.13 прогнозировать свойства соединений с различными видами связи и типами кристаллических решеток; | Навыки высокого порядка | 1 | 8 | РО | 3 | 5 | ||
| 10.1.4.12 понимать механизм образования водородной связи; | Знание и понимание | 1 | 1 | МВО | 1 | 1 | ||
| 10.1D Стехиом етрия | 10.2.2.1 производить расчеты, с применением понятий «молярная концентрация», «молярный объем» при нормальных и стандартных условиях; | Применение | 1 | 7 | РО | 10 | 6 | 6 |
| 10.2.2.2 вычислять количества вещества (массу, объем и количество частиц) продуктов реакций по известным количествам (массам, объемам и количеству частиц) исходных веществ, если одно из них взято в избытке и содержит определенную долю примесей; | ||||||||
| 10.2.2.3 вычислять выход продукта в процентах от теоретически возможного; | ||||||||
| | Всего баллов | | | | | | 30 | 30 |
Задания суммативного оценивания за 1 четверть по предмету «Химия»
-
Водородная связь образуется:-
между атомами в молекуле водорода Н2; -
между молекулами метана СН4; -
между молекулами аммиака NH3; -
между молекулами этанола С2Н5ОН в жидком этаноле.
-
А) верно только I утверждение
-
верно I и II утверждения -
верно II и III утверждения -
верно III и IV утверждения.
[1]
-
Верны ли следующие суждения о строении молекулы ацетилена:-
тип гибридизации – sp2 -
тройная связь между атомами углерода -
валентный угол 180˚ -
длина связи 0,120нм -
гомолог ацетилена С3Н6
-
А) верны I, II, III утверждения
-
верны II, III и IV утверждения -
верны II, III, IV, V утверждения -
верны III и V утверждения
[1]
-
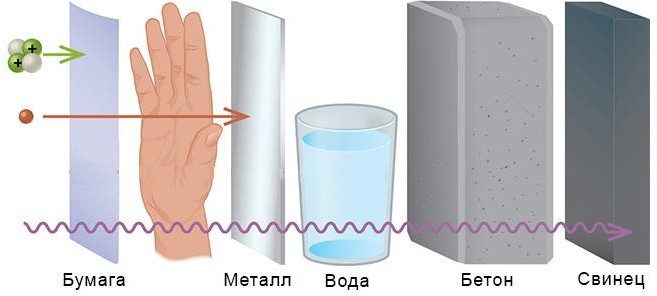 а) На рисунке изображена различная проникающая способность радиоактивных частиц. Подпишите на картинке обозначение (или название) проникающих радиоактивных частиц
а) На рисунке изображена различная проникающая способность радиоактивных частиц. Подпишите на картинке обозначение (или название) проникающих радиоактивных частиц
1)
2)
3)
[1]
b) Приведите примеры (не менее двух) использования радиоактивных изотопов.
-
а). Запишите уравнение радиоактивного распада, в результате которого натрий 22Na
11
превращается в магний 22Mg.
12
b) Запишите уравнение α распада для 22Mg.
12
[1]
[1]
-
На рисунке изображена электронно-графическая формула элемента.
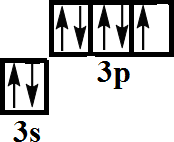
а) Определите знак элемента и запишите его электронную формулу.
[1]
b) Элементы кислород и сера расположены в одной группе. Валентность кислорода в соединениях равна II. Объясните, с точки зрения строения атома, почему кислород не проявляет в соединениях высшую валентность VI, в отличие от серы (пример - SO3).
[1]
-
Месторождения меди в Казахстане славятся на весь мир. 92% медной руды экспортируется за границу. Медь и изделия из нее очень широко применяются в промышленности и повседневной жизни человека.
а) Назовите тип химической связи в меди.
[1]
-
Приведите один пример применения меди. На Вашем примере объясните, на каком свойстве основано применение данного металла.
Применение
[1]
Свойство
[1]
Объяснение свойства с позиции строения и связи.
[1]
-
Медь – ковкий и пластичный металл. Объясните причину этих свойств меди.
-
Для того чтобы посеребрить медное изделие массой 12г, содержащее 20% примесей, его опустили в стакан, содержащий 500мл 0,11М раствора нитрата серебра (I). Когда изделие вынули, то оказалось, что масса серебряного покрытия составила 5г. Рассчитайте массовую долю выхода продукта от теоретически возможного.
[6]
-
Алмаз, метан и белый фосфор имеют схожее пространственное строение молекул.
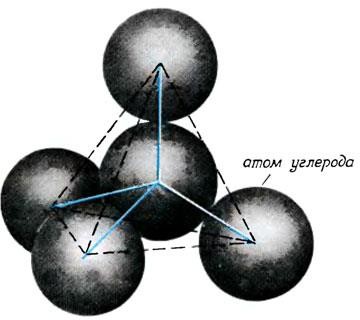
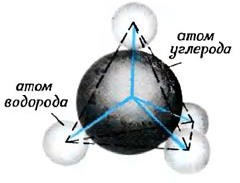
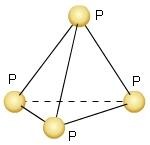
В то же время, алмаз – самое твердое вещество, метан – газообразное вещество, белый фосфор – твердое, воскообразное вещество.
а) Объясните различия свойств этих веществ.
[2]
b) Алмаз и графит – аллотропные видоизменения углерода. Графит используется в качестве смазочного материала и грифелей карандашей, а алмаз - как режущее и абразивное вещество. На основании строения кристаллической решетки, объясните области применения графита.
[1]
с) Фосфор имеет четыре аллотропных модификаций, одна из которых металлический фосфор. При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу. Предположите свойства металлического фосфора.
| | Цвет | Плотность («<» или «>», сравнить с белым фосфором) | Температура плавления («<» или «>», сравнить с белым фосфором) | Проводимость электрического тока |
| Металлический фосфор | | | | |
[2]
-
До своего открытия этот элемент был известен под именем, данным Менделеевым, - эка-иод (Eka-Iodum). Было очевидно, что элемент 85 должен обладать интересными промежуточными свойствами. Элемент 85 получил свое название астат (Astatium) в 1947 г. Название произведено от греческого означающего "неустойчивый, шаткий", так как все изотопы астата оказались коротко - живущими.