Файл: Спецификация суммативного оценивания за четверть по предмету Химия.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 354
Скачиваний: 6
СОДЕРЖАНИЕ
Правила проведения суммативного оценивания
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 1 ЧЕТВЕРТЬ
Структура суммативного оценивания
Характеристика заданий суммативного оценивания за 1 четверть
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 2 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 2 четверть
Структура суммативного оценивания
Характеристика заданий суммативного оценивания за 2 четверть
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 3 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 3 четверть Продолжительность – 40 минут
Структура суммативного оценивания
Характеристика заданий суммативного оценивания за 3 четверть
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 4 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 4 четверть Продолжительность – 40 минут
Структура суммативного оценивания
Характеристика заданий суммативного оценивания за 4 четверть
-
обр
Вычислите изменение стандартной энтальпии образования, Ho , безводного нитрата магния, Mg(NO3)2, используя закон Гесса.
…………………. кДж моль-1
[2]
-
Вычислите изменение стандартной энтропии, So, безводного нитрата магния, Mg(NO3)2.
…………………..Дж К -1моль-1
[1]
-
Определите возможность самопроизвольного протекания данной реакции. Объясните ответ.
[1]
-
а) Используя данные:
| Вещество и состояние | ΔHo обр298 кДж/моль | ΔGo обр298 кДж/моль | So 298 Дж/(моль К) |
| NaCl (к) | -411,41 | -384,4 | 72,13 |
| NaF (к) | -572,8 | -542,6 | 51,17 |
| Cl2 (г) | 0 | 0 | 222,98 |
| F2 (г) | 0 | 0 | 202,7 |
298
Вычислите Δ????0 для реакции: 2NaF (к) + Cl2 (г) = 2NaCl (к) + F2
(b) Можно ли получить фтор по данной реакции? Обоснуйте ответ.
[1]
[2]
Схема выставления баллов
| № | Ответ | Балл | Дополнительная информация |
| 1 | В | 1 | |
| 2а) | Не изменится, так как в исходных веществах и продуктах реакции одинаковое число моль, давление на такую систему не влияет | 1 | |
| 2b) | Так как реакция эндотермическая, то повышение температуры смещает равновесие в сторону продуктов реакции | 1 | |
| | 2NO2 ↔ N2O4 | | |
| 2c) | 1) повысить давление, так как в продуктах реакции меньший объем | 1 | |
| | 2) увеличить концентрацию NO2 | 1 | |
| 3a) | | 1 | 3 |
| 3b) | Она уменьшается | 1 | |
| 3с) | Увеличит концентрацию | 1 | |
| 4а) | В реакции 2Н2(г) + О2(г) = 2Н2О(г) в левой части уравнения 3V реагирующих веществ, справа - 2V продуктов реакции. При повышении давления равновесие сместится в сторону меньшего объема, т.е. в право. В реакции N2(г) + O2(г) ↔ 2NO(г)в левой части уравнения 2V реагирующих веществ и справа - 2V продуктов реакции. На такую систему изменение давления никак не влияет | 1 | |
| | С2Н4(г) + Н2О(г)↔ С2Н5ОН(г) + Q | | |
| | Давление: повышение Р смещает равновесие в сторону | 1 | |
| | меньшего объема, в сторону выхода спирта (2V – 1V) | | |
| 4b) | Температура: повышение приведет к обратной реакции (реакция экзотермическая) | 1 | |
| | Концентрация: если увеличить концентрацию любого | | |
| | из реагирующих веществ равновесие сместится в | 1 | |
| | сторону продуктов реакции. И наоборот. | | |
| 5 | В | 1 | |
| 6 | В | 1 | |
| 7 | 2SО2(г) + O2(г) = 2SO3(г) v1 = [SО2]2*[О2] v2= [2SО2]2*[2О2] =22*2 = 8 раз | 1 1 | |
| 8а) | В продуктах реакции выпала кристаллическая сера | 1 | |
| 8b) | | Оп ыт | Объём Na2S2O 3 (водн; см3) | Объём дистиллиро ванной воды (см3) | Объём HCl (водн; см3) | t (c) | Скорос ь реакци 1/t | | 3 2 | 3 балла за все правильные расчёты, 2 балла – за 4 верных расчета 1 балл – за три 1б – за оси 1б – за правильный график |
| 1 | 50 | 0 | 5 | 50 | 0,02 | |||||
| 2 | 40 | 10 | 5 | 60 | 0,017 | |||||
| 3 | 30 | 20 | 5 | 75 | 0,013 | |||||
| 4 | 20 | 30 | 5 | 10 0 | 0,01 | |||||
| 5 | 10 | 40 | 5 | 24 0 | 0,004 | |||||
| Верно построенный график зависимости 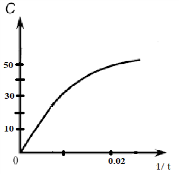 примерный вид графика примерный вид графика | ||||||||||
| 8с) | Чем больше концентрация тиосульфата натрия, тем быстрее из него выпадает осадок – сера. | 1 | | |||||||
| 9а) | -790 | 2 | | |||||||
| 9b) | +164 | 1 | | |||||||
| 9с) | Возможно, так как So> 0 | 1 | | |||||||
| 10 а) | находим , получим: = 2 (NaCl) - 2 (NaF) = 2(-384,03) – 2(-54!,0) = +313,94 кДж. | 1 | | |||||||
| 10 b) | нет То, что > 0, указывает на невозможность протекания прямой реакции при Т = 298 К и давлении взятых газов равном 1,01325 Па (760 мм. рт. ст. = 1 атм). | 1 1 | | |||||||
| | Итого | 30 | ||||||||
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 3 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 3 четверть Продолжительность – 40 минут
Количество баллов – 30
Типы заданий:
МВО – задания с множественным выбором ответов;
КО – задания, требующие краткого ответа;
РО – задания, требующие развернутого ответа.
Структура суммативного оценивания
Данный вариант состоит из 11 заданий, включающих задания с множественным выбором ответов, с кратким и развёрнутым ответами.
В вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения.
В вопросах, требующих развёрнутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Задание может содержать несколько структурных частей/ подвопросов.
Характеристика заданий суммативного оценивания за 3 четверть
| Раздел | Проверяемые цели | Уровень мыслительных навыков | Кол. задани й* | № задан ия* | Тип задани я* | Время на выполне ние, мин* | Бал л* | Балл за раздел |
| 10.3А Окислит ельно- восстано вительн ые реакции | 10.2.3.1 составлять уравнения окислительно- восстановительных реакций методом электронного баланса; | Применение | 1 | 3 | КО | 3 | 3 | 6 |
| 10.2.3.9 применять эмпирические правила для прогнозирования продуктов электролиза на электродах; | Применение | 1 | 4 | КО | 3 | 3 | ||
| 10.3В Аналити ческие методы | 10.1.4.15 называть области применения инструментальных методов анализа | Знание и понимание | 1 | 1 | МВО | 1 | 1 | 1 |
| 10.3С Элемент ы 17 группы | 10.2.1.5 объяснять закономерности изменения физических и химических свойств галогенов в группе; | Применение | 1 | 2 | МВО | 2 | 1 | 10 |
| 10.2.1.7 планировать и проводить работу по экспериментальному распознаванию галогенид ионов; | Навыки высокого порядка | 1 | 5 | РО | 7 | 6 | ||
| 10.2.1.8 объяснять использование хлора для обеззараживания воды и оценивать преимущества и недостатки данного процесса; | Применение | 1 | 6 | РО | 5 | 3 | ||
| 10.3D Элемент ы 2 (II) группы | 10.2.1.12 называть области применения важнейших соединений щелочноземельных металлов; | Знание и понимание | 1 | 7 | МВО | 3 | 1 | 5 |
| 10.2.1.13 планировать и проводить эксперимент по качественному определению катионов металлов 2 (II) группы. | Навыки высокого порядка | 1 | 8 | РО | 5 | 4 |