ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 816
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
HCl Cl2 HCl NaCl AgCl
-
Оксид серы (IV) растворили в воде при повышенном давлении. К раствору прилили бромную воду, а затем избыток хлорида бария. Отфильтрованный и высушенный осадок имел массу 23,3 г. Сколько граммов брома вступило в реакцию
-
 Как называются кислородсодержащие кислоты хлора и их соли
Как называются кислородсодержащие кислоты хлора и их соли  Изобразите графически эти кислоты. Получите их из соответствующих ангидридов. Как изменяется их сила и окислительная способность с увеличением степени окисления хлора
Изобразите графически эти кислоты. Получите их из соответствующих ангидридов. Как изменяется их сила и окислительная способность с увеличением степени окисления хлора -
Напишите электронную формулу фтора. Какова его степень окисления в соединениях Опишите кратко химические свойства фтора, их особенности, отличия от свойств других галогенов. Запишите соответствующие реакции.
Опишите кратко химические свойства фтора, их особенности, отличия от свойств других галогенов. Запишите соответствующие реакции. -
Осуществите превращения и определите неизвестные вещества:
FeSO4


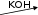 Сl2 Б В
Сl2 Б В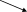 NaBr А Cl2 H2SO4
NaBr А Cl2 H2SO4CaOCl2
-
 Напишите электронные формулы хлора и фтора в нормальном и возбужденном состоянии. Какие степени окисления могут иметь эти элементы Приведите примеры соответствуюих соединений.
Напишите электронные формулы хлора и фтора в нормальном и возбужденном состоянии. Какие степени окисления могут иметь эти элементы Приведите примеры соответствуюих соединений.
- 1 ... 45 46 47 48 49 50 51 52 ... 61
Водород
Порядковый номер 1. Атомная масса 1,008. Число известных изотопов 4, из которых протий (относительная атомная масса 1), дейтерий (относительная атомная масса 2), тритий (относительная атомная масса 3) обнаружены в природе, а четвертый (относительная атомная масса 4) получен искусственно.
Во Вселенной водород является самым распространенным элементом - он составляет до 90% массы Солнца и многих звезд. В земной коре содержание водорода составляет 1%. В природе он встречается как в свободном состоянии (вулканические газы, газы нефтяных скважин, верхние слои атмосферы), Так и в виде соединений. Наиболее распространенным соединением является вода, где содержание водорода составляет 11,11%.
Ядро атома содержит один протон, вокруг которого один электрон, занимающий S-орбиталь 1S1. Такая простая структура обусловливает множество уникальных свойств водорода. Во-первых, атом водорода имеет лишь валентную электронную оболочку. Поэтому ее единственный электрон не экранирован от действия заряда ядра внутренними электронами. Во-вторых, этой внешней электронной оболочке достаточно приобрести или потерять лишь один электрон, чтобы достичь устойчивой электронной конфигурации. Наконец, поскольку атом водорода состоит из одного электрона и одного протона, он имеет очень малые размеры, его ковалентный радиус (0,03 нм) имеет минимальное значение среди всех элементов. Эти особенности объясняют многие отличительные свойства водорода и его особое положение в периодической таблице.
Электронная структура единственной оболочки водорода аналогична внешней оболочке щелочных металлов.
Подобно щелочным металлам водород имеет высшую степень окисления +1 однозарядного иона Н+. Эти основные причины позволяют рассматривать водород как представителя I группы, но все они являются в достаточной степени формальными. Так, энергия ионизации атома водорода намного больше, чем у атомов щелочных металлов. Другое важное различие: для щелочных металлов невозможно существование отрицательно заряженных ионов, тогда как для водорода степень окисления -1 достаточно характерна (например, Na+1H-1). Радиус иона Н+ несравненно меньше радиусов ионов щелочных металлов, а последние, как известно, характеризуются наибольшими радиусами из всех прочих положительных ионов. Таким образом, между водородом и щелочными металлами наблюдается лишь некоторое формальное сходство.
Водород также включается в главную подгруппу седьмой группы. У него до завершения внешней оболочки благородного газа гелия не достает одного
электрона. То же самое наблюдается у галогенов, у которых до образования оболочки соответствующего благородного газа тоже не хватает одного электрона. В соединениях с металлами водород, как и галогены, образует отрицательный ион Н- (Na+1H-1 и Na+1Cl-1 ). Они по своему характеру напоминают типичные соли, похожие на соответствующие производные фтора и хлора. Водород, как и галогены, характеризуется высоким значением энергии ионизации. Именно эти особенности позволяют помещать водород в подгруппу галогенов.
Все отмеченные факты говорят о том, что водород следует рассматривать как особый химический элемент, не имеющий полных аналогов.
Химическиесвойства. Для водорода характерны три типа электронных процессов:
-
потеря электрона с образованием протона Н0 – e = Н+ ; здесь проявля- ются его восстановительные свойства -
присоединение электрона, приводящее к образованию гидрид-иона Н0 + e=Н- , существующего только в кристаллических гидридах самых
электро-положительных металлов (NaH, CaH2 ); окислительные свойства;
-
формирование двухэлектронных связей (ковалентные связи), происходящих при образовании молекулы водорода и его взаимодействии с неметаллами.
Энергия связи в молекуле велика, что объясняет сравнительно малую активность молекулярного водорода при обычных условиях.
Так, при обычной температуре водород реагирует лишь с фтором (даже в темноте) и с хлором (при освещении).
H2 + F2 = 2HF H2 + Cl2 = 2HCl
При нагревании обратимо реагирует с бромом, иодом, а также с серой и азотом:
H2 + S = H2S 3H2 + N2 = 2NH3
(катализатор, высокое давление)
С кислородом при повышенной температуре водород реагирует с образованием овды с выделением большого количества тепла:
2H2 + О2 = 2H2О
Реагирует также со сложными веществами при нагревании, например:
Во всех