ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 821
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Химическая связь
Образование химической связи между атомами происходит за счет электронов, расположенных на внешнем и предвнешнем (для d- и f-элементов) энергетических уровнях и связанных с ядром наименее прочно. Их называют валентными электронами.
В зависимости от характера распределения электронной плотности в молекуле различают три основных типа химической связи: ковалентную, ионную и металлическую.
Связь, осуществляемая за счет электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной.
Существует два механизма образования ковалентной связи: обменный - за счет неспаренных электронов, находящихся в невозбужденном или возбужденном состоянии, и донорно-акцеторный.
Число связей за счет неспаренных электронов, которые может образовывать атом данного элемента с другими атомами, равно числу этих электронов в основном или возбужденном состоянии. Например, атом углерода в основном состоянии имеет 2 неспаренных электрона и может образовать 2 химические связи, например, с двумя неспаренными электронами атома кислорода (получается молекула С=О):
 2р2 2р4
2р2 2р4| | | |
 2s2
2s2 C O
В возбужденном состоянии атом углерода имеет на внешнем уровне четыре неспаренных электрона
и может образовать 4 химические связи,
| | | |
| | | |

 2р2 2р3
2р2 2р3  2s2
2s2 C C
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
например, с четырьмя неспаренными электронами двух атомов кислорода (получается молекула О=С=О).
Число образуемых атомом ковалентных связей называется ковалентностью элемента в соответствующем соединении.
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что один из атомов, участвующих в образовании химической связи, предоставляет неподеленную электронную пару (его называют донором), а второй (акцептор)-свободную орбиталь. Примером может служить образование иона аммония NH4+ из молекулы аммиака NH3 и иона водорода Н+:
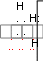
 Н
Н. .
Н : N : + H+
. . Н
NH3 – донор, Н+- акцептор
+
 N:Н
N:НВсе связи N-H в ионе аммония равноценны.
Донорно-акцепторный механизм образования ковалентной связи особенно распространен в комплексных соединениях.
Для обоих механизмов образования ковалентной связи справедливо следующее: атом не может образовать ковалентных связей больше, чем число валентных орбиталей.

 Ковалентная связь характеризуется длиной (это расстояние между ядрами атомов, образовавших связь), прочностью (она определяется энергией связи - это энергия, которую необходимо затратить для разрыва всех связей в молекулах, составляющих 1 моль вещества), направленностью (все орбитали, кроме S, имеют пространственную направленность, поэтому и связи, образованные за счет перекрывания таких орбиталей, обладают определенной направленностью), полярностью (если общая электронная пара расположена симметрично между ядрами атомов, то связь неполярная - это молекулы, состоящие из атомов одного элемента, если общая электронная пара смещена в сторону более электроотрицательного атома, то связь полярная - это молекулы, образованные атомами разных элементов).
Ковалентная связь характеризуется длиной (это расстояние между ядрами атомов, образовавших связь), прочностью (она определяется энергией связи - это энергия, которую необходимо затратить для разрыва всех связей в молекулах, составляющих 1 моль вещества), направленностью (все орбитали, кроме S, имеют пространственную направленность, поэтому и связи, образованные за счет перекрывания таких орбиталей, обладают определенной направленностью), полярностью (если общая электронная пара расположена симметрично между ядрами атомов, то связь неполярная - это молекулы, состоящие из атомов одного элемента, если общая электронная пара смещена в сторону более электроотрицательного атома, то связь полярная - это молекулы, образованные атомами разных элементов).Различают и -ковалентные связи. связь – это связь, при
 образовании которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры атомов. связь это связь, при образовании которой перекрывание электронных облаков происходит вдоль линии, перпендикулярной прямой, соединяющей центры атомов.
образовании которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры атомов. связь это связь, при образовании которой перекрывание электронных облаков происходит вдоль линии, перпендикулярной прямой, соединяющей центры атомов.Ковалентная связь, образованная одной парой электронов, называется одинарной (простой), двумя - двойной, тремя - тройной. Двойную и тройную связи называют кратными.
Ионной называется химическая связь, осуществляемая за счет сил электростатического притяжения противоположно заряженных ионов. К возникновению ионов приводит большая разница электроотрицательностей ( 1,7) атомов, образующих связь. Поэтому ионная связь возникает между
атомами типичных металлов и неметаллов (CsF, BaCl2, Na2O). Например, образование молекулы NaCl можно представить следующим образом:

 0 + 0 - + -
0 + 0 - + -Na - 1e Na , Cl + 1e Cl , Na + Cl = NaCl
+
-
Ионы Na и Cl имеют завершенные (8-электронные) внешние оболочки.
Молекул с чисто ионной связью нет. Даже в молекуле CsF электронная пара лишь на 89% принадлежит фтору, а на 11% - цезию. Поэтому говорят о степени ионности связи.
В отличие от ковалентной ионная связь является ненаправленной и ненасыщенной. Каждый ион способен притягивать, координировать вокруг себя равноценно по всем направлениям ионы противоположного знака. Например, координационное число в кристалле NaCl равно 6, т.е. каждый ион Na+ связан с 6 ионами Cl- и наоборот.
Металлической называется связь, осуществляемая между всеми атомами в кристаллической решетке металла совокупностью обобществленных валентных электронов.
Атомы металлов имеют на внешнем уровне много свободных орбиталей и мало валентных электронов. Валентные электроны имеют возможность беспрепятственно переходить от атома к атому, становятся общими для всех атомов, образующих кристаллическую решетку металла. Совокупность хаотически движущихся обобществленных валентных электронов называют электронным газом. Его высокой подвижностью объясняются такие характерные свойства металлов, как тепло - и электропроводность; отсутствием
локализованных химических связей - пластичность и ковкость.
Энергия (прочность) металлической связи растет с увеличением числа валентных электронов и заряда ядра.
Примеры решения задач
Пример 1. Какую валентность, обусловленную неспаренными электронами, может проявлять фосфор в нормальном и возбужденном состояниях ?
Решение
Распределение электронов внешнего энергетического уровня фосфора 3s23p3:
| | | | | |
 3d0
3d0 15P
Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного S-электрона на 3d-подуровень:
| | | | | |
3d1
 15P
15PСледовательно, в соответствии с числом неспаренных электронов, валентность фосфора в нормальном состоянии равна трем (например, РН3), а в возбужденном - пяти (например, РСl5).
Пример 2. Как изменяется прочность связи Н-Э в ряду Н2О - Н2S - H2Se - H2Te ?
Решение
В указанном ряду размеры валентных электронных облаков элементов (O,S,Se,Te) возрастают, что приводит к уменьшению степени их перекрывания с электронным облаком атома водорода и к возрастающему удалению области перекрывания от ядра атома соответствующего элемента. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т.е. ослабление связи. Таким образом, при переходе от кислорода к теллуру прочность связи Н-Э уменьшается.
Пример 3. Что такое гибридизация валентных орбиталей ? Какое строение