ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 841
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
имеют молекулы типа АВn, если связь в них образуется за счет sp-,sp2-,sp3- гибридизации орбиталей атома А?
Решение
Теория валентных связей предполагает участие в образовании ковалентных связей не только «чистых» атомных орбиталей, но и
«смешанных», так называемых гибридных атомных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей равно числу исходных.
Гибридизация орбиталей и пространственная конфигурация молекул
Валентным называется угол между двумя ближайшими связями в молекуле.

 каковы ее свойства
каковы ее свойства
распределите электроны по энергетическим ячейкам, определите его ковалентность. Какие связи в молекуле азота
К важнейшим величинам, характеризующим химические системы, относятся внутренняя энергия U, энтальпия, энтропия S и энергия Гиббса. Все эти величины представляют собой функции состояния и не зависят от способа, которым это состояние, достигнуто.
 Химические реакции чаще осуществляются при постоянном давлении (изобарный процесс). В подобных случаях для энергетической характеристики процесса удобнее пользоваться не внутренней энергией U, а энтальпией H(кДж).
Химические реакции чаще осуществляются при постоянном давлении (изобарный процесс). В подобных случаях для энергетической характеристики процесса удобнее пользоваться не внутренней энергией U, а энтальпией H(кДж).
 В результате реакции энтальпия системы либо возврастает ( Н 0), т.е. система поглощает энергию из внешней среды (эндотермическая реакция), либо уменьшается ( Н
В результате реакции энтальпия системы либо возврастает ( Н 0), т.е. система поглощает энергию из внешней среды (эндотермическая реакция), либо уменьшается ( Н  0), т.е. система выделяет энергию (экзотермическая реакция).
0), т.е. система выделяет энергию (экзотермическая реакция).
В основе расчетов, связанных с изменением энтальпии или внутренней энергии системы в результате реакции, лежит закон Гесса:
Тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Упрощает многие термохимические расчеты следствие из закона Гесса:


 Стандартное изменение энтальпии химической реакции равно разности между суммами стандартных энтальпий образования продуктов реакции и исходных веществ: Н=
Стандартное изменение энтальпии химической реакции равно разности между суммами стандартных энтальпий образования продуктов реакции и исходных веществ: Н=
Нпрод Нисх.
Стандартными в термодинамике приняты следующие условия: давление 101,3 кПа (1 атмосфера); температура 298 К (250С).
Стандартной энтальпией образования сложного вещества (кДж/моль) называется стандартное изменение энтальпии при химической реакции (или, короче, стандартная энтальпия реакции) образования 1 моля данного вещества из простых веществ.
Энтальпии образования простых веществ принимаются равными нулю. Направление, в котором самопроизвольно протекает химическая реакция,
определяется совместным действием двух факторов:
1) тенденцией к переходу системы в состояние с наименьшей внутренней энергией (энтальпией) и 2) тенденцией к достижению наиболее вероятного состояния, т.е. состояния, которое может быть реализовано наибольшим числом равновероятных способов (микросостояний).
Мерой вероятности состояния системы является энтропия S(Дж/моль.К) - величина, пропорциональная числу равновероятных микросостояний, которыми может быть реализована данное макросостояние.
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое, из жидкого в газообразное, при расширении газов, растворении вещества и т.п. Во всех этих случаях упорядоченность системы понижается, беспорядок возрастает, поэтому можно говорить, что энтропия является мерой беспорядка системы.
Влияние обеих тенденций на направление протекание процесса отражает функция состояния, называемая энергией Гиббса; она связана с энтальпией и энтропией соотношением


 G = H TS
G = H TS


 Как и в случае Н и S, изменение энергии Гиббса G (KДж) в результате химической реакции (или, короче, энергия Гиббса реакции) равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ:
Как и в случае Н и S, изменение энергии Гиббса G (KДж) в результате химической реакции (или, короче, энергия Гиббса реакции) равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ:
Gпрод Gисх

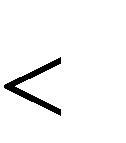 Изменение энергии Гиббса G является мерой самопроизвольного протекания химической реакции: при постоянных температуре и давлении реакция может протекать самопроизвольно в сторону уменьшения энергии Гиббса ( G=G2-G1 0).
Изменение энергии Гиббса G является мерой самопроизвольного протекания химической реакции: при постоянных температуре и давлении реакция может протекать самопроизвольно в сторону уменьшения энергии Гиббса ( G=G2-G1 0).


 Из анализа выражения G= H-T видно, что наиболее вероятно
Из анализа выражения G= H-T видно, что наиболее вероятно
самопроизвольное протекание экзотермических реакций, протекающих с повышением энтропии и, с другой стороны, самопроизвольное протекание эндотермических реакций, идущих с уменьшением энтропии, невозможно. При низких температурах наиболее вероятно протекание экзотермических реакций, при высоких - реакций, сопровождающихся возрастанием энтропии.
Решение
Теория валентных связей предполагает участие в образовании ковалентных связей не только «чистых» атомных орбиталей, но и
«смешанных», так называемых гибридных атомных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и одинаковой энергии. Число гибридных орбиталей равно числу исходных.
Гибридизация орбиталей и пространственная конфигурация молекул
| Тип молекулы | Исходные орбитали атома А | Тип гиб- ридизации | Число гиб- ридных ор- биталей атома А | Пространствен- ная конфигу- рация молекул | Валентный угол* |
| АВ2 | S+P | SP | 2 | линейная | 1800 |
| АВ3 | S+P+P | SP2 | 3 | треугольная | 1200 |
| АВ4 | S+P+P+P | SP3 | 4 | тетраэдрическая | 109028 |
Валентным называется угол между двумя ближайшими связями в молекуле.
Задачи
-
Какова современная формулировка периодического закона В чем причина периодической зависимости свойств элементов и образуемых ими соединений от заряда ядра атомов
В чем причина периодической зависимости свойств элементов и образуемых ими соединений от заряда ядра атомов
-
Что такое ковалентность элементов Напишите электронные формулы кислорода и серы, распределите электроны по энергетическим ячейкам в нормальном и возбужденном состояниях, определите возможные ковалентности этих элементов.
Напишите электронные формулы кислорода и серы, распределите электроны по энергетическим ячейкам в нормальном и возбужденном состояниях, определите возможные ковалентности этих элементов. -
 Какая химическая связь называется ковалентной
Какая химическая связь называется ковалентной Как она образуется и каковы ее свойства
Как она образуется и каковы ее свойства -
 Какая химическая связь называется ионной
Какая химическая связь называется ионной Как она образуется и
Как она образуется и
 каковы ее свойства
каковы ее свойства-
Что такое и связь Напишите электронную формулу азота,
распределите электроны по энергетическим ячейкам, определите его ковалентность. Какие связи в молекуле азота
-
Определите характер связей в молекулах LiF, HF, F2 . Укажите смещение электронного облака связи с учетом величин электроотрицательностей (ЭО). -
Что такое гибридизация Определите тип гибридизации валентных орбиталей бериллия при образовании молекулы BeCl2 и ее форму.
Определите тип гибридизации валентных орбиталей бериллия при образовании молекулы BeCl2 и ее форму. -
Определите направление связей в молекуле аммиака и ее форму. Укажите смещение электронного облака связи с учетом величин ЭО. -
 Определите форму молекул H2O, H2Se. Как изменяется величина валентного угла в молекулах этих соединений
Определите форму молекул H2O, H2Se. Как изменяется величина валентного угла в молекулах этих соединений -
Что такое допорно-акценторная связь Объясните механизм образования ионов BF4- ; [Zn(NH3)4]2+.
-
Термохимия и термодинамика
К важнейшим величинам, характеризующим химические системы, относятся внутренняя энергия U, энтальпия, энтропия S и энергия Гиббса. Все эти величины представляют собой функции состояния и не зависят от способа, которым это состояние, достигнуто.
В основе расчетов, связанных с изменением энтальпии или внутренней энергии системы в результате реакции, лежит закон Гесса:
Тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Упрощает многие термохимические расчеты следствие из закона Гесса:

 Стандартное изменение энтальпии химической реакции равно разности между суммами стандартных энтальпий образования продуктов реакции и исходных веществ: Н=
Стандартное изменение энтальпии химической реакции равно разности между суммами стандартных энтальпий образования продуктов реакции и исходных веществ: Н=
Нпрод Нисх.
Стандартными в термодинамике приняты следующие условия: давление 101,3 кПа (1 атмосфера); температура 298 К (250С).
Стандартной энтальпией образования сложного вещества (кДж/моль) называется стандартное изменение энтальпии при химической реакции (или, короче, стандартная энтальпия реакции) образования 1 моля данного вещества из простых веществ.
Энтальпии образования простых веществ принимаются равными нулю. Направление, в котором самопроизвольно протекает химическая реакция,
определяется совместным действием двух факторов:
1) тенденцией к переходу системы в состояние с наименьшей внутренней энергией (энтальпией) и 2) тенденцией к достижению наиболее вероятного состояния, т.е. состояния, которое может быть реализовано наибольшим числом равновероятных способов (микросостояний).
Мерой вероятности состояния системы является энтропия S(Дж/моль.К) - величина, пропорциональная числу равновероятных микросостояний, которыми может быть реализована данное макросостояние.
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое, из жидкого в газообразное, при расширении газов, растворении вещества и т.п. Во всех этих случаях упорядоченность системы понижается, беспорядок возрастает, поэтому можно говорить, что энтропия является мерой беспорядка системы.
Влияние обеих тенденций на направление протекание процесса отражает функция состояния, называемая энергией Гиббса; она связана с энтальпией и энтропией соотношением


 Как и в случае Н и S, изменение энергии Гиббса G (KДж) в результате химической реакции (или, короче, энергия Гиббса реакции) равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ:
Как и в случае Н и S, изменение энергии Гиббса G (KДж) в результате химической реакции (или, короче, энергия Гиббса реакции) равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ:Gпрод Gисх
 Из анализа выражения G= H-T видно, что наиболее вероятно
Из анализа выражения G= H-T видно, что наиболее вероятносамопроизвольное протекание экзотермических реакций, протекающих с повышением энтропии и, с другой стороны, самопроизвольное протекание эндотермических реакций, идущих с уменьшением энтропии, невозможно. При низких температурах наиболее вероятно протекание экзотермических реакций, при высоких - реакций, сопровождающихся возрастанием энтропии.