ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 831
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
= 0-(-0,279) = 0,279 С:
n 11,04/М

 tкр. = K m = K = 1,86= 0,279
tкр. = K m = K = 1,86= 0,279
m р-ля 0,8
(М – молярная масса глицерина).
Отсюда M = (186 11,04) / (0,279 0,8) = 92 г/ моль.
Пример 3.Осмотическое давление раствора, в 250 мл которого содержит- ся 3 г сахара, при 12 С равно 83,14 кПа. Определите относительную молеку- лярную массу сахара.
Решение
По закону Вант-Гоффа Росмт. = СМRT. Молярность раствора (см. тему IX) равна:
СМ = n/V (моль/л).
Тогда Росмт. = (n/V) RT = [(3/M) / 0.25] 8,314 (273 + 12) = 83,14
(M – молярная масса сахара).
3 8,314 (273+12)
Отсюда М == 342 г / моль;
83,14 0,25
относительная молекулярная масса сахара равна 342.
Пример 4. Давление насыщенного пара воды при 100 С равно 101,325 кПа. Определить давление пара воды над 10%-ным раствором глицерина.
Решение
Из закона Рауля следует, что давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя:
p1 = p0 N1
Мольная доля (см. тему IX) растворителя равна
N1 = n1 / (n1 + n2).
 900/18
900/18
Тогда p1 = 101,325 = 100,74 кПа 900/18 + 100/342
(342 – молярная масса глицерина, 18 – молярная масса воды).
вещества в 660 мл раствора, при 27 С равно 24,91 кПа. Вычислите относительную молекулярную массу растворенного вещества.
Водородный показатель
По способности проводить электрический ток в растворе или расплаве вещества делятся на электролиты и неэлектролиты. Электропроводность растворов и расплавов объясняется процессом распада электролитов на ионы, который называется электролитической диссоциацией.
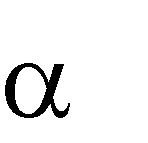 В водных растворах одни электролиты полностью распадаются на ионы, другие - частично, т.е. часть молекул электролита остается в растворе в недиссоциированном виде.
В водных растворах одни электролиты полностью распадаются на ионы, другие - частично, т.е. часть молекул электролита остается в растворе в недиссоциированном виде.
Число , показывающее, какая часть молекул растворенного вещества распалось на ионы, называется степенью электролитической диссоциации:
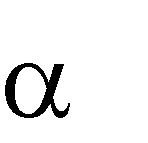
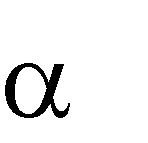
 Степень диссоциации зависит от природы растворяемого вещества и растворителя, температуры (с ее ростом , как правило, увеличивается), концентрации раствора (при разбавлении раствора возрастает).
Степень диссоциации зависит от природы растворяемого вещества и растворителя, температуры (с ее ростом , как правило, увеличивается), концентрации раствора (при разбавлении раствора возрастает).
 В зависимости от степени диссоциации электролиты делятся ( 30 % при концентрации раствора 0,1 моль/л) и слабые ( концентрации 0,1 моль/л).
В зависимости от степени диссоциации электролиты делятся ( 30 % при концентрации раствора 0,1 моль/л) и слабые ( концентрации 0,1 моль/л).
К сильным электролитам относятся:
сильные
% при
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами, например:
СН3СООН ↔ Н+ + СН3СОО-,
 к которому применим закон действия масс, и можно определить константу равновесия, называемую в таких случаях константой диссоциации:
к которому применим закон действия масс, и можно определить константу равновесия, называемую в таких случаях константой диссоциации:
К= Н+ СН3СОО- / СН3СООН недисс

 В случае электролита АX, диссоциирующего на ионы А+ и Х-, К и
В случае электролита АX, диссоциирующего на ионы А+ и Х-, К и  связаны соотношением
связаны соотношением
 К= 2См(1- ) (Закон разбавления Оствальда).
К= 2См(1- ) (Закон разбавления Оствальда).


 Если 1, то 1- 1. Тогда выражение закона разбавления упрощается: К= 2 См, откуда = (К / См )1/2.
Если 1, то 1- 1. Тогда выражение закона разбавления упрощается: К= 2 См, откуда = (К / См )1/2.

 Концентрации ионов А+ составляют:
Концентрации ионов А+ составляют:
А+ = X- См или А+ = X- = (К См)1/2
 Вода, будучи очень слабым электролитом, диссоциирует в незначительной степени:
Вода, будучи очень слабым электролитом, диссоциирует в незначительной степени:
Н2О Н+ + ОН-
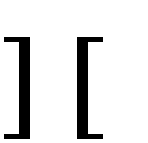
Этому процессу соответствует константа диссоциации
К= Н+ ОН- / Н2О
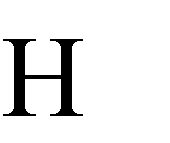 Поскольку
Поскольку  очень мала, то равновесная концентрация недиссоциированных молекул воды [ 2О] практически равна общей концентрации воды, т.е. 1000/18=55,55 моль/л, и выражение для константы диссоции воды можно преобразовать:
очень мала, то равновесная концентрация недиссоциированных молекул воды [ 2О] практически равна общей концентрации воды, т.е. 1000/18=55,55 моль/л, и выражение для константы диссоции воды можно преобразовать:
2
[H+] [OH-]=K[H2O] =KH O
KН2О- постоянная при данной температуре величина, называется ионным произведением воды; она зависит только от температуры.
2
В чистой воде при 25 С [Н+]=[ОН-]=10-7 моль/л, следовательно, КН О=10-14.
Эта величина справедлива и для разбавленных водных растворов. Концентрации [H+] и [ОН-] взаимосвязаны: чем больше одна величина,
тем меньше другая, и наоборот. Но их произведение при данной температуре остается постоянным.
Растворы, в которых [Н+]=[ОН-], называются нейтральными, если [H+] [OH-], -кислыми, если [OH-] [H+], - щелочными.
Вместо концентрации ионов Н+ и ОН- удобнее пользоваться их
обратными десятичными логарифмами; эти величины обозначаются символами



 и и называются соответственно водородным и гидроксильным показателями:
и и называются соответственно водородным и гидроксильным показателями:
lg [H+] и lg [OH-]


n 11,04/М
 tкр. = K m = K = 1,86= 0,279
tкр. = K m = K = 1,86= 0,279 m р-ля 0,8
(М – молярная масса глицерина).
Отсюда M = (186 11,04) / (0,279 0,8) = 92 г/ моль.
Пример 3.Осмотическое давление раствора, в 250 мл которого содержит- ся 3 г сахара, при 12 С равно 83,14 кПа. Определите относительную молеку- лярную массу сахара.
Решение
По закону Вант-Гоффа Росмт. = СМRT. Молярность раствора (см. тему IX) равна:
СМ = n/V (моль/л).
Тогда Росмт. = (n/V) RT = [(3/M) / 0.25] 8,314 (273 + 12) = 83,14
(M – молярная масса сахара).
3 8,314 (273+12)
Отсюда М == 342 г / моль;
83,14 0,25
относительная молекулярная масса сахара равна 342.
Пример 4. Давление насыщенного пара воды при 100 С равно 101,325 кПа. Определить давление пара воды над 10%-ным раствором глицерина.
Решение
Из закона Рауля следует, что давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя:
p1 = p0 N1
Мольная доля (см. тему IX) растворителя равна
N1 = n1 / (n1 + n2).
 900/18
900/18Тогда p1 = 101,325 = 100,74 кПа 900/18 + 100/342
(342 – молярная масса глицерина, 18 – молярная масса воды).
Задачи
-
Определить температуру замерзания раствора, полученного при раство- рении 300 г сахара (C12H22O11) в 1500 г воды Криоскопическая постоянная воды равна 1,86 град.
Криоскопическая постоянная воды равна 1,86 град. -
Давление насыщенного пара воды при 100 С равно 101,325 кПа (760 мм рт.ст.). Определить давление пара воды над 4%-ным раствором мочевины CO(NH2)2 при этой температуре. -
Вычислить осмотическое давление при 0 С раствора, содержащего 3,72 г анилина C6H5NH2 в 1л раствора. -
Вычислить, сколько глицерина C3H5 (OH)3 нужно растворить в 200 г воды, чтобы раствор замерзал при -5 С. Криоскопическая постоянная воды 1,86 град. -
Раствор, содержащий 2,05 г растворенного вещества в 650 г воды, замерзает при –0,93 С. Вычислить относительную молекулярную массу растворенного вещества. Криоскопическая постоянная воды 1,86 град. -
Вычислить температуру замерзания водного 30%-ного раствора C2H5OH. Криоскопическая постоянная воды 1,86 град. -
Определить температуру кипения раствора, содержащего 3,46 г мочевины CO(NH2)2 в 100 г воды. Эбуллиосопическая постоянная воды равна 0,52 град. -
 Вычислить, при какой температуре замерзает водный 35%-ный раствор глицерина C3H5 (OH)3 Криоскопическая постоянная воды 1,86 град.
Вычислить, при какой температуре замерзает водный 35%-ный раствор глицерина C3H5 (OH)3 Криоскопическая постоянная воды 1,86 град. -
Осмотическое давление раствора, содержащего 0,4 г растворенного
вещества в 660 мл раствора, при 27 С равно 24,91 кПа. Вычислите относительную молекулярную массу растворенного вещества.
-
Осмотическое давление раствора, содержащего 3 г сахара в 250 мл раствора, равно 83,08 кПа при 12 С. Определите относительную молекулярную массу сахара.
-
Электролитическая диссоциация. Ионное произведение воды.
Водородный показатель
По способности проводить электрический ток в растворе или расплаве вещества делятся на электролиты и неэлектролиты. Электропроводность растворов и расплавов объясняется процессом распада электролитов на ионы, который называется электролитической диссоциацией.
Число , показывающее, какая часть молекул растворенного вещества распалось на ионы, называется степенью электролитической диссоциации:
 Степень диссоциации зависит от природы растворяемого вещества и растворителя, температуры (с ее ростом , как правило, увеличивается), концентрации раствора (при разбавлении раствора возрастает).
Степень диссоциации зависит от природы растворяемого вещества и растворителя, температуры (с ее ростом , как правило, увеличивается), концентрации раствора (при разбавлении раствора возрастает). В зависимости от степени диссоциации электролиты делятся ( 30 % при концентрации раствора 0,1 моль/л) и слабые ( концентрации 0,1 моль/л).
В зависимости от степени диссоциации электролиты делятся ( 30 % при концентрации раствора 0,1 моль/л) и слабые ( концентрации 0,1 моль/л).К сильным электролитам относятся:
сильные
% при
-
почти все соли; -
из важнейших кислот: HCl, HBr, HJ, H2SO4, HNO3, HClO4; -
щелочи - гидроксиды металлов IА и IIА групп, кроме Mg и Be. Слабые электролиты и электролиты средней силы: -
почти все органические вещества; -
из кислот: H2CO3, H2S, HCN, H2SiO3, H3PO4, H2SO3, H2C2O4; -
гидроксиды, кроме щелочей, а также NH4OH; -
многие бинарные соединения (Н2О, оксиды и др.).
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами, например:
СН3СООН ↔ Н+ + СН3СОО-,
 к которому применим закон действия масс, и можно определить константу равновесия, называемую в таких случаях константой диссоциации:
к которому применим закон действия масс, и можно определить константу равновесия, называемую в таких случаях константой диссоциации:К= Н+ СН3СОО- / СН3СООН недисс
 В случае электролита АX, диссоциирующего на ионы А+ и Х-, К и
В случае электролита АX, диссоциирующего на ионы А+ и Х-, К и  К= 2См(1- ) (Закон разбавления Оствальда).
К= 2См(1- ) (Закон разбавления Оствальда). Если 1, то 1- 1. Тогда выражение закона разбавления упрощается: К= 2 См, откуда = (К / См )1/2.
Если 1, то 1- 1. Тогда выражение закона разбавления упрощается: К= 2 См, откуда = (К / См )1/2.
 Концентрации ионов А+ составляют:
Концентрации ионов А+ составляют:А+ = X- См или А+ = X- = (К См)1/2
Н2О Н+ + ОН-
Этому процессу соответствует константа диссоциации
К= Н+ ОН- / Н2О
2
[H+] [OH-]=K[H2O] =KH O
KН2О- постоянная при данной температуре величина, называется ионным произведением воды; она зависит только от температуры.
2
В чистой воде при 25 С [Н+]=[ОН-]=10-7 моль/л, следовательно, КН О=10-14.
Эта величина справедлива и для разбавленных водных растворов. Концентрации [H+] и [ОН-] взаимосвязаны: чем больше одна величина,
тем меньше другая, и наоборот. Но их произведение при данной температуре остается постоянным.
Растворы, в которых [Н+]=[ОН-], называются нейтральными, если [H+] [OH-], -кислыми, если [OH-] [H+], - щелочными.
Вместо концентрации ионов Н+ и ОН- удобнее пользоваться их
обратными десятичными логарифмами; эти величины обозначаются символами



 и и называются соответственно водородным и гидроксильным показателями:
и и называются соответственно водородным и гидроксильным показателями:lg [H+] и lg [OH-]

