ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 02.12.2023
Просмотров: 1361
Скачиваний: 9
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
ИНДИВИДУАЛЬНОЕ ДОМАШНЕЕ ЗАДАНИЕ № 1
ИОННО-ЭЛЕКТРОННЫЙ МЕТОД УРАВНИВАНИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ.
Варианты заданий для самостоятельной работы
ИНДИВИДУАЛЬНОЕ ДОМАШНЕЕ ЗАДАНИЕ № 2
3.3. Варианты заданий для самостоятельной работы по химической термодинамике и кинетике
Варианты заданий для самостоятельной работы.
Варианты заданий для самостоятельной работы
Термодинамические величины для простых веществ и соединений
C D
pc pd
Kp ,
A B
pa pb
(2.16)
где
pa, pb, pc, pd
-
равновесные парциальные давления компонентов.
A B C D
Расчет
GT
при неравновесных парциальных давлениях компонентов:
pc pd
GT
RT lnC D ln Kp ,
(2.17)
pa pb
A B
где
pA, pB, pC, pD
-
исходные парциальные давления компонентов.
Примеры типовых расчетов
Пример2.1.Определить стандартную энтальпию образования твердого
Al2O3 на основании следующих данных:
1) Al2O3(тв) +3SO3(г) Al2 (SO4 )3(тв),
2) 2S(тв) +3O2(г) 2SO3(г),
3) 2Al(тв) +2S(тв) +6O2(г) Al2 (SO4 )3(тв),
H 574.44 кДж;
1
2
H 790.36 кДж;
3
H 3434.98 кДж.
Решение.Напишем реакцию образования 1 моль твердого Al2O3 из про- стых веществ:
4) 2Al(тв) + 3 O2(г) Al2O3(тв),

H
хкДж/моль.
2 f4
На основании (2.1) можно рассчитать стандартную энтальпию образова- ния твердого Al2O3, если провести алгебраическое суммирование уравнений реакций 1–3и соответствующих тепловых эффектов.
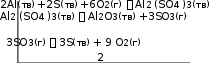 В уравнение получения Al2O3 из простых веществ не входят SO3, Al2(SO4)3, S, поэтому исключим их из уравнений реакций 1–3. Для этого умножаем уравнение 1 на –1, уравнение 2 умножаем на –3/2, а затем склады- ваем уравнение 3 с полученными в результате указанных преобразований уравнениями 1 и 2:
В уравнение получения Al2O3 из простых веществ не входят SO3, Al2(SO4)3, S, поэтому исключим их из уравнений реакций 1–3. Для этого умножаем уравнение 1 на –1, уравнение 2 умножаем на –3/2, а затем склады- ваем уравнение 3 с полученными в результате указанных преобразований уравнениями 1 и 2:
2
2Al(тв) + 3 O2(г) Al2O3(тв)
Уравнение реакции, полученное в результате проведенных преобразова- ний, тождественно уравнению реакции 4.
Подобные преобразования следует провести и с тепловыми эффектами заданных реакций:

H H 3 H H,
f4 1 2 2 3
-

H
574.44 3 790.36 3434.98 1675 кДж/моль.
f4 2
Пример2.2.Определить при стандартных условиях изменение энталь- пии и внутренней энергии реакции:
CH4(г) +СО2(г) 2СО(г) +2Н2(г).
Определить изменение энтальпии при этих же условиях, если прореаги- ровало 10 л метана.
f , 298
f , 298
f , 298
2H
Решение.Используя соотношение (2.2), запишем для заданной реакции
H
298
f, 298
(CO) 2H
(H2 ) H
(CH4 ) H
(CO2 ).
В полученное соотношение подставим значения стандартных энтальпий об- разования компонентов реакции из прил. 1:
H
298
2 (110.5) 2 0 (74.85) (393.51) 247.36 кДж.
При взаимодействии 1 моль СН4 поглощается 247.36 кДж теплоты. При нормальных условиях объем 1 моль СН4 занимает 22.4 л. Объем 1 моль СН4 при стандартной температуре в соответствии с законом Гей-Люссака:
 22.4 V2 ;
22.4 V2 ;V2 22.4298 24.45 л.
273 298 273
Составим пропорцию:
24.45 л СН4 при взаимодействии поглощают 247.36 кДж теплоты,
а 10 л СН4 при взаимодействии поглощают HкДж теплоты;
 H 10 247.36 101.17 кДж.
H 10 247.36 101.17 кДж.24.45
По соотношению (2.4) рассчитываем
U
298
. Изменение числа молей
газообразных веществ в этой реакции:
4 2 2 моль .
U
298
247.36 2 8.31103 298 244.89 кДж.
Пример 2.3. Найти стандартную энтальпию образования фенола
Н (C H O ) , если известно, что при сгорании 18.8 г фенола кри-
f, 298 6 6 (кр)
сталлического до СО2(г) и Н2О(ж) при стандартных условиях выделяется
611.156 кДж теплоты.
Решение.Напишем термохимическое уравнение реакции горения фенола:
С6H6O(кр) +7О2(г) 6СО2(г) +3Н2О(ж) +Qp;
MC6H6O 94 г/моль.
Из
условия задачи и уравнения реакции можно составить пропорцию:
18.8 г фенола при сгорании выделяют 611.156 кДж теплоты;
94 г фенола при сгорании выделяют Qp
кДж теплоты;
p
Q 94611.156 3055.78 кДж.
18.8
Так как
Qp Н, то
H
298
3055.78 кДж.
Используя соотношение
6H
(2.2), можно написать:
H
298
f, 298
(CO2 ) 3H
(H2O) 7H
(O2 ) H
(C6H6O)
f, 298
f, 298
f, 298
или
H
(C H O) 6H
(CO ) 3H
(H O) 7H
(O ) H .
f, 298 6 6
f, 298 2
f, 298 2
f, 298 2 298
В полученное соотношение подставим найденное значение
H
298
реак-
ции и значения стандартных энтальпий образования О2(г), СО2(г) и Н2О(ж) из прил. 1:
H (C H O ) 6 (393.51) 3 (285.84)
298 6 6 (кр)
7 0 (3055.78) 162.8 кДж/моль.