ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 02.12.2023
Просмотров: 1362
Скачиваний: 9
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
ИНДИВИДУАЛЬНОЕ ДОМАШНЕЕ ЗАДАНИЕ № 1
ИОННО-ЭЛЕКТРОННЫЙ МЕТОД УРАВНИВАНИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ.
Варианты заданий для самостоятельной работы
ИНДИВИДУАЛЬНОЕ ДОМАШНЕЕ ЗАДАНИЕ № 2
3.3. Варианты заданий для самостоятельной работы по химической термодинамике и кинетике
Варианты заданий для самостоятельной работы.
Варианты заданий для самостоятельной работы
Термодинамические величины для простых веществ и соединений
Bi2O3 10OH 4e 2BiO43 5H2O
 2 Br2 2e 2Br
2 Br2 2e 2Br
4
Bi2O3 10OH 2Br2 2BiO 3 4Br 5H2O.
Коэффициенты из ионного уравнения перенесем в молекулярное урав- нение реакции и проверим, уравнялись ли при этом ионы K+, не принимав- шие участия в окислительно-восстановительной схеме:
Bi2O3 2Br2 10KOH 2K3BiO4 4KBr 5H2O.
Проводим проверку правильности расстановки стехиометрических ко- эффициентов по кислороду: количество атомов кислорода в левой и правой части уравнения окислительно-восстановительной реакции должно быть одинаковым.
Пример 1.7. Закончить и уравнять ионно-электронным методом окисли- тельно-восстановительную реакцию, протекающую в нейтральной среде:
NaNO2 KMnO4 H2O NaNO3 MnO2 …
Решение.Перепишем данное уравнение реакции в ионной форме:
2 4 2 3 2
Na NO K MnO H O Na NO MnO
и определим для восстановителя его окисленную форму:
2 3
NO NO ,
а для окислителя – его восстановленную форму:
4 2
MnO MnO .
…,
Для процессов окисления и восстановления необходимо сначала соста- вить материальный баланс с помощью молекул Н2О, а затем баланс по элек- трическим зарядам. Два полученных уравнения следует просуммировать, умножив каждое из них на коэффициенты, подобранные так, чтобы число электронов, теряемых восстановителем, было равно числу электронов, при- обретаемых окислителем. В результате получаем ионное уравнение окисли- тельно-восстановительной реакции:

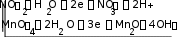 3
3
 2
2
3NO 3H O 2MnO 4H O 3NO 6H+ 2MnO
8OH.
2 2 4 2 3 2
Обратим внимание, что ионы OH и Н+ связываются в малодиссоции- рующее соединение – воду, после чего приведем подобные члены в левой и правой частях уравнения:
3NO 2MnO 7H O 3NO 2MnO 6H O 2OH ,
2 4 2 3 2 2
2 4 2 3 2
3NO 2MnO H O 3NO 2MnO 2OH .
Коэффициенты из ионного уравнения перенесем в молекулярное урав- нение реакции и проверим, уравнялись ли при этом ионы Na+ и K+, не при- нимавшие участия в окислительно-восстановительной схеме:
3NaNO2 2KMnO4 H2O 3NaNO3 2MnO2 2KOH.
Проводим проверку правильности расстановки стехиометрических ко- эффициентов по кислороду: количество атомов кислорода в левой и правой части уравнения окислительно-восстановительной реакции должно быть одинаковым.
1
0.62 · 10–4 м3. Какова истинная формула соединения?
а) написать электронную формулу атома элемента № 57;
б) записать в форме энергетических ячеек электронную конфигурацию валентного уровня атома мышьяка в основном и «возбужденном» состояниях.
KI+K2Cr2O7 +H2SO4 I2 +Cr2(SO4)3+... Cr(OH)3+Br2 +KOH K2CrO4 +KBr+…
1.18 · 10–4 м3 при Т= 280 К и р= 0.97 · 105 Па. Какова истинная формула со- единения?
а) написать электронную формулу атома элемента №78;
б) записать в форме энергетических ячеек электронную конфигурацию валентного уровня атома хлора в
основном и «возбужденном» состояниях.
K3[Fe(CN)6] между K+ и
[Fe(CN)6 ]3 ? Укажите валентность и степени окисления элементов.
Cu2S+HNO3 Cu(NO3)2 +SO2 +NO+... Cr2O3+KNO3+KOH K2CrO4 +KNO2 +…
а) написать электронную формулу атома элемента № 90;
б) записать в форме энергетических ячеек электронную конфигурацию валентного уровня атома свинца в основном и «возбужденном» состояниях.
Zn+HNO3+H2SO4 ZnSO4 +N2O+… Mn(OH)2 +Cl2 +KOH MnO2 +KCl+…
Вычислите процентное содержание кристаллизационной воды. Выведите формулу кристаллогидрата соды.
а) написать электронную формулу атома элемента № 53;
б) записать в форме энергетических ячеек электронную конфигурацию валентного уровня атома йода в основном и «возбужденном» состояниях.
гандам в соединении сти элементов.
K3[Fe(CN)6] . Укажите степени окисления и валентно-
 2 Br2 2e 2Br
2 Br2 2e 2Br4
Bi2O3 10OH 2Br2 2BiO 3 4Br 5H2O.
Коэффициенты из ионного уравнения перенесем в молекулярное урав- нение реакции и проверим, уравнялись ли при этом ионы K+, не принимав- шие участия в окислительно-восстановительной схеме:
Bi2O3 2Br2 10KOH 2K3BiO4 4KBr 5H2O.
Проводим проверку правильности расстановки стехиометрических ко- эффициентов по кислороду: количество атомов кислорода в левой и правой части уравнения окислительно-восстановительной реакции должно быть одинаковым.
Пример 1.7. Закончить и уравнять ионно-электронным методом окисли- тельно-восстановительную реакцию, протекающую в нейтральной среде:
NaNO2 KMnO4 H2O NaNO3 MnO2 …
Решение.Перепишем данное уравнение реакции в ионной форме:
2 4 2 3 2
Na NO K MnO H O Na NO MnO
и определим для восстановителя его окисленную форму:
2 3
NO NO ,
а для окислителя – его восстановленную форму:
4 2
MnO MnO .
…,
Для процессов окисления и восстановления необходимо сначала соста- вить материальный баланс с помощью молекул Н2О, а затем баланс по элек- трическим зарядам. Два полученных уравнения следует просуммировать, умножив каждое из них на коэффициенты, подобранные так, чтобы число электронов, теряемых восстановителем, было равно числу электронов, при- обретаемых окислителем. В результате получаем ионное уравнение окисли- тельно-восстановительной реакции:

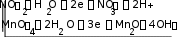 3
3 2
23NO 3H O 2MnO 4H O 3NO 6H+ 2MnO
8OH.
2 2 4 2 3 2
Обратим внимание, что ионы OH и Н+ связываются в малодиссоции- рующее соединение – воду, после чего приведем подобные члены в левой и правой частях уравнения:
3NO 2MnO 7H O 3NO 2MnO 6H O 2OH ,
2 4 2 3 2 2
2 4 2 3 2
3NO 2MnO H O 3NO 2MnO 2OH .
Коэффициенты из ионного уравнения перенесем в молекулярное урав- нение реакции и проверим, уравнялись ли при этом ионы Na+ и K+, не при- нимавшие участия в окислительно-восстановительной схеме:
3NaNO2 2KMnO4 H2O 3NaNO3 2MnO2 2KOH.
Проводим проверку правильности расстановки стехиометрических ко- эффициентов по кислороду: количество атомов кислорода в левой и правой части уравнения окислительно-восстановительной реакции должно быть одинаковым.
- 1 2 3 4 5 6 7 8 9 ... 54
Варианты заданий для самостоятельной работы
1
-
Соединение содержит 92.26 % углерода и 7.74 % водорода. 1.95 · 10–4 кг этого соединения занимают при Т= 300 К и р = 105 Па объем, равный
0.62 · 10–4 м3. Какова истинная формула соединения?
-
Требуется:
а) написать электронную формулу атома элемента № 57;
б) записать в форме энергетических ячеек электронную конфигурацию валентного уровня атома мышьяка в основном и «возбужденном» состояниях.
-
Укажите тип гибридизации орбиталей в молекуле ССl4. -
Закончите и уравняйте ионно-электронным методом окислительно- восстановительные реакции:
KI+K2Cr2O7 +H2SO4 I2 +Cr2(SO4)3+... Cr(OH)3+Br2 +KOH K2CrO4 +KBr+…
2
-
Соединение содержит 62.8 % серы и 37.2 % фтора. Масса этого со- единения 5.1 · 10–4 кг в газообразном состоянии занимает объем, равный
1.18 · 10–4 м3 при Т= 280 К и р= 0.97 · 105 Па. Какова истинная формула со- единения?
-
Требуется:
а) написать электронную формулу атома элемента №78;
б) записать в форме энергетических ячеек электронную конфигурацию валентного уровня атома хлора в
основном и «возбужденном» состояниях.
-
Какая связь осуществляется в соединении
K3[Fe(CN)6] между K+ и
[Fe(CN)6 ]3 ? Укажите валентность и степени окисления элементов.
-
Закончите и уравняйте ионно-электронным методом окислительно- восстановительные реакции:
Cu2S+HNO3 Cu(NO3)2 +SO2 +NO+... Cr2O3+KNO3+KOH K2CrO4 +KNO2 +…
1 2 3 4 5 6 7 8 9 ... 54
3
-
При сжигании 2.4 · 10–4 кг некоторого соединения азота с водородом получено 1.7 · 10–4 м3 азота при Т = 273 К и р = 105 Па. Плотность пара этого соединения по воздуху 1.1. Какова истинная формула вещества? -
Требуется:
а) написать электронную формулу атома элемента № 90;
б) записать в форме энергетических ячеек электронную конфигурацию валентного уровня атома свинца в основном и «возбужденном» состояниях.
-
Укажите тип гибридизации орбиталей в молекуле AlF3. -
Закончите и уравняйте ионно-электронным методом окислительно- восстановительные реакции:
Zn+HNO3+H2SO4 ZnSO4 +N2O+… Mn(OH)2 +Cl2 +KOH MnO2 +KCl+…
4
-
После удаления кристаллизационной воды из 1.25 · 10–3 кг кристалло- гидрата карбоната натрия масса сухого остатка оказалась равной 4.63 · 10–4 кг.
Вычислите процентное содержание кристаллизационной воды. Выведите формулу кристаллогидрата соды.
-
Требуется:
а) написать электронную формулу атома элемента № 53;
б) записать в форме энергетических ячеек электронную конфигурацию валентного уровня атома йода в основном и «возбужденном» состояниях.
-
Укажите тип химической связи между комплексообразователем и ли-
гандам в соединении сти элементов.
K3[Fe(CN)6] . Укажите степени окисления и валентно-