ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2159
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Теоретические основы химии
Курс лекций
Автор МАЛАШОНОК ИРИНА ЕВГЕНЬЕВНА
Кафедра общей и неорганической химии
Введение
Химия - наука о веществах, закономерностях их превращений и применении. В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений. Все наблюдаемые в природе явления делятся на физические и химические. Явления, сопровождаемые изменением агрегатного состояния и не приводящие к превращению одних веществ в другие – физические (плавление льда, дробление мела). К физическим относятся также процессы образования новых веществ с изменением состава ядер атомов. Явления, при которых из одних веществ образуются новые вещества – химические (химические реакции).
Для установления свойств вещества необходимо иметь чистое вещество. Вещества в чистом виде не встречаются. Встречающиеся в природе вещества представляют собой смеси. Смеси отличаются от химического соединения тем, что их составные части сохраняют свои индивидуальные свойства и могут быть выделены физическими методами. В химических соединениях составные части не сохраняют своих свойств и не могут быть выделены. Вещества, выпускаемые химической промышленностью, также содержат примеси. Поэтому для указания степени их чистоты существуют различные марки: ТЕХН., Ч – чистый, ЧДА – чистый для анализа; ХЧ – химически чистый; ОЧ – особенно чистый, СЧ – спектрально чистый. Допустимое количество примесей регламентируется ГОСТом.
Основные понятия и законы химии Атомно - молекулярное учение.
Объектом изучения в химии являются химические элементы и из соединения .
1.Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
2.Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3.Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент - это вид атомов, характеризующийся определенным зарядом ядра и строением электронной оболочки. В настоящее время известно 117 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
|
Массовое число Заряд ядра |
A Z |
Э |
63 29 |
Cu и |
65 29 |
Cu; |
35 17 |
Cl и |
37 17 |
Cl |
Химическая формула - это условная запись состава вещества с помощью химических знаков. В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений. Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам. Простые вещества- молекулы, состоят из атомов одного и того же элемента. Cложные вещества – вещества, молекулы которых состоят из атомов различных химических элементов.
Международная единица атомных масс равна 1/12 массы изотопа 12C - основного изотопа природного углерода.
1 а.е.м = 1/12 m (12C) = 1,66057 10-24 г
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
Ar(Mg) = 24,312 m (Mg) = 24,312·1,66057 10-24 = 4,037 10-23 г.
Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mг
=
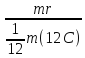 ,
,
где mr ‑ масса молекулы данного вещества.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Примеры.
Mг(B2O3) = 2 Ar(B) + 3 Ar(O) = 2 11 + 3 16 = 70
Mг(KAl(SO4)2) = 1 Ar(K) + 1 Ar(Al) + 2 Ar(S) + 8 Ar(O) = 39 + 27 +64 + 8·16 = 258.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м. Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения - моль.
Количество вещества, моль, означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода 12C.
Число Авогадро (NA). Количество частиц в 1 моле любого вещества одно и то же и равно 6,02 1023. Постоянная Авогадро NA имеет размерность - моль-1.
Пример. Сколько молекул содержится в 6,4 г серы? Молекулярная масса серы равна 32 г /моль. Определяем количество г/моль вещества в 6,4 г серы:
n(S) = m(S) / M(S) = 6,4г / 32 г/моль = 0,2 моль
Определим число структурных единиц (молекул), используя постоянную Авогадро NA
N(S) = n(S) NA = 0,2 6,02·1023 = 1,2·1023
Молярная масса показывает массу 1 моля вещества (обозначается M). Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества n:
M
=
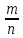 .
.
Молярная
масса вещества численно равна его
относительной молекулярной массе,
однако первая величина имеет размерность
г/моль,
а вторая - безразмерная. Это означает,
что если масса некоторой молекулы равна,
например, 80 а.е.м. (SO3),
то масса одного моля молекул равна 80 г.
Постоянная Авогадро является коэффициентом
пропорциональности, обеспечивающим
переход от молекулярных соотношений к
молярным. Все утверждения относительно
молекул остаются справедливыми для
молей (при замене, в случае необходимости,
а.е.м. на г). Например, уравнение реакции:
2Na + Cl2![]() 2NaCl, означает, что два атома натрия
реагируют с одной молекулой хлора или,
что одно и то же, два моль натрия реагируют
с одним молем хлора.
2NaCl, означает, что два атома натрия
реагируют с одной молекулой хлора или,
что одно и то же, два моль натрия реагируют
с одним молем хлора.
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
С точки зрения атомно-молекулярного учения закон сохранения массы объясняется так: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. Так как число атомов до реакции и после остается неизменным, но их общая масса также не изменяется.
С точки зрения атомно-молекулярного учения закон кажется очевидным.
Однако в процессе химической реакции неизменными остаются только ядра атомов. А атом – не только ядро, но и окружающие его электроны. В процессе взаимодействия веществ реагентов происходит перестройка внешних электронных уровней, атом изменяется и совсем не очевидно, что его масса остается постоянной.
Может возникнуть возражение, число электронов так, как и ядер, сохраняется. Это правильно, но опять обратимся к уравнению Эйнштейна Е = mc2, выражающего связь между массой тела и энергией процесса.
Если происходит выделение энергии, масса продуктов уменьшается и наоборот. Изменение массы можно вычислить, зная тепловой эффект реакции.
Например
С
+ О2
= СО2; ∆Н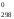 = –393,5 кДж
= –393,5 кДж
∆m = 4,4 10–12 кг = 4,4 10–9 г
С выделившейся энергией рассеивается часть вещества. Масса моль СО2 меньше суммы масс С и О2 на 0,0000000044 г. Такое изменение массы находится вне пределов современных методов её определения. Точность определения молярных масс в таблице Менделеева ограничена четырьмя знаками после запятой. Поэтому следует считать, что в эттом месте теория с практикой расходятся. С практической точки зрения закон сохранения массы в химических процессах выполняется. Он выполняется строго, если не дать возможности выделяющейся энергии рассеиваться в окружающем пространстве или поступить из неё.
Значение закона сохранения массы для химии лишь историческое. Он утверждает материальность химических элементов и веществ. Широко используется в технологических расчетах при составлении баланса масс реагентов и продуктов промышленных производств.
Для характеристики природы веществ особенно важен заряд: нейтрон 0, электрон –, протон +. Электрон и протон обладают одинаковыми, но противоположными по знаку зарядами 1,6 10-19 Кл. заряд протона и электрона дальше неделим, поэтому называется элементарным. При образовании атомных ядер и при формировании вокруг них электронных оболочек заряды элементарных частиц алгебраически суммируются. Ядро атома гелия состоит из двух протонов и двух нейтронов, имеет суммарный заряд +2, а электронная оболочка состоит из двух электронов, (–2) в целом атом электронейтрален. Закон сохранения заряда: алгебраическая сумма зарядов любой изолированной системы постоянна. Взаимодействие между атомами и ядрами и электронными оболочками осуществляется благодаря наличию у них зарядов и служит основой при возникновении химической связи и образовании химических соединений.
Составление химических уравнений
Включает три этапа:
1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками "+" и "=" :
HgO = Hg + O2
2. Подбор коэффициентов для каждого вещества так, чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаково:
2HgO = 2Hg + O2
3. Проверка числа атомов каждого элемента в левой и правой частях уравнения.