ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2226
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Повышение температуры кипения растворов нелетучих веществ ΔTк = Tк – T°к пропорционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора. Коэффициент пропорциональности E есть эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества.
![]() (6)
(6)
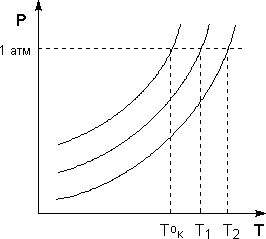
Рис. 5 Повышение температуры кипения разбавленных растворов
Т.о., второй закон Рауля можно в наиболее общем виде сформулировать следующим образом:
Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества.
Второй закон Рауля является следствием из первого; данный закон справедлив только для бесконечно разбавленных растворов. Коэффициенты пропорциональности в уравнениях (5,6) – эбулиоскопическая и криоскопическая константы – имеют физический смысл соответственно повышения температуры кипения и понижения температуры замерзания растворов с моляльной концентрацией, равной 1 моль/кг. Однако, поскольку такие растворы не являются бесконечно разбавленными, эбулиоскопическая и криоскопическая константы не могут быть непосредственно определены и относятся поэтому к числу т.н. экстраполяционных констант.
Пример 1. Вычислить давление насыщенного пара раствора, содержащего 45 г глюкозы С6Н12О6 в 720 г воды при 25оС. Давление пара воды при 25оС составляет 23,76 мм рт. ст.
Решение.
р0
= 23,76 мм рт. ст., МС Н
Н О
О = 180 г/моль, МН
= 180 г/моль, МН О
= 18 г/моль. Для решения задачи воспользуемся
уравнением:
О
= 18 г/моль. Для решения задачи воспользуемся
уравнением:
р
= р0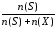 .
.
рН О
= 23,76
О
= 23,76
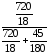 = 23,76
= 23,76
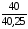 = 23,61 мм рт. ст.
= 23,61 мм рт. ст.
Пример 2. Вычислить tкип и tкр 4,6%-ного раствора глицерина С3Н8О3 в воде.
Решение.
100 г раствора содержат 4,6 г глицерина в
95,4 г воды, МС Н
Н О
О )
= 92 г/моль, kэб
Н
)
= 92 г/моль, kэб
Н О
= 0,52о,
kкр.
= 1,86о
О
= 0,52о,
kкр.
= 1,86о
Для расчета можно использовать приведенные выше формулы:
tкип
=
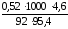 =
0,27оС;
=
0,27оС;
tкр
=
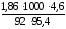 = 0,975оС.
= 0,975оС.
Получаем искомые величины: tкип = 100,27оС и tкр = –0,975оС.
5. Осмотическое давление разбавленных растворов
Если разделить два раствора с различной концентрацией полупроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться явление самопроизвольного перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный – осмос. Осмотические свойства раствора количественно характеризуются величиной осмотического давления. Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, есть осмотическое давление π. Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора С и может быть рассчитано по уравнению (7):
![]() (7)
(7)
Уравнение (7) есть т.н. принцип Вант-Гоффа:
осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор.
Осмос играет важнейшую роль в процессах жизнедеятельности животных и растений, поскольку клеточная плазматическая мембрана является полупроницаемой. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления.
6. Понятие активности растворенного вещества
Если концентрация растворенного вещества не превышает 0,1 моль/л, раствор неэлектролита обычно считают разбавленным. В таких растворах взаимодействие между молекулами растворителя существенно преобладает над взаимодействием между молекулами растворителя и растворенного вещества, поэтому последним обычно можно пренебречь. В случае более концентрированных растворов такое приближение неправомерно и для формального учета взаимодействия частиц растворителя и растворенного вещества, а также частиц растворенного вещества между собой, вводится эмпирическая величина, заменяющая концентрацию – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f, который является мерой отклонения свойств реального раствора от идеального:
![]() (8)
(8)
Как правило, коэффициент активности меньше единицы (при малых концентрациях считают f = 1 и а = С). Необходимо отметить, что активность компонента не прямо пропорциональна его концентрации – коэффициент активности уменьшается с увеличением концентрации.
Слабые электролиты. Константа диссоциации
Распад растворенного вещества на ионы под действием молекул растворителя называется электролитической диссоциацией. Вещества, распадающиеся в растворах или расплавах на положительно и отрицательно заряженные ионы, называются электролитами. Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Кислоты, основания и соли являются электролитами.
Все соли состоят из ионов, поэтому при растворении под действием полярных молекул воды происходит распад кристалла соли на ионы (катионы и анионы). Этот процесс сопровождается образованием акватированных (гидратированных) ионов в растворе:
[Al2(SO4)3]
+ aq = 2{Al3+}aq
+ 3{SO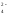 }aq,
}aq,
или упрощенно:
Al2(SO4)3
= 2Al3+
+ 3SO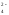 .
.
Слабые многоосновные кислоты и слабые многокислотные основания диссоциируют ступенчато.
Кислота:
I ст.
H2SO3
⇄
Н+
+ HSO ;
;
II
ст. HSO ⇄
Н+
+ SO
⇄
Н+
+ SO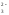 .
.
Основание: I ст. Mg(OH)2 ⇄ MgOH+ + OH-;
II ст. MgOH+ ⇄ Mg2+ + OH-.
Качественной характеристикой способности электролита к диссоциации является степень диссоциации (). По значению степени диссоциации электролиты делят на сильные и слабые. К сильным относят те электролиты, у которых 1. К слабым относят те электролиты, у которых 0. Сильными электролитами в водных растворах являются почти все соли, некоторые кислоты (HCl, HBr, HI, HClO4, HMnO4, H2CrO4, H2SO4, HNO3, HClO3, H2SeO4) и гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Диссоциация сильных электролитов – необратимый процесс:
HNO3
Н+
+ NO .
.
Диссоциация слабых электролитов – обратимый процесс:
HNO2
⇄
H+
+ NO .
.
Концентрация ионов в водных растворах сильных электролитоврассчитывается по формуле
Сионов = С n, (1)
где – степень электролитической диссоциации; С – концентрация электролита (моль/л); n – число ионов данного вида в одном моле электролита. В случае слабых электролитов:
Сион. = С. (2)
В растворах слабых электролитов устанавливается равновесие между молекулами электролита и ионами, образовавшимися за счет диссоциации слабого бинарного электролита, например:
СН3СООН ⇄ СН3СОО– + Н+.
На основании закона действующих масс можно записать выражение константы равновесия:
Kс
=
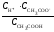 (3).
(3).
Константу равновесия Кс в данном случае называют константой диссоциации и обозначают К. Константа диссоциации электролита связана со степенью диссоциации соотношением, которое является математическим выражением закона разбавления Оствальда:
K
=
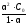 , (4)
, (4)
где С0 – молярная концентрация растворенного электролита, моль/л.
Выражение (4) применимо только для слабых электролитов. Этой формулой следует пользоваться для расчетов в случаях, когда отношение С/К 102 ( 0,1).
Если 1, то соотношение (1) упрощается:
К 2 С0. (5)
Если
1, то
=
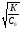 (6)
(6)
Константы диссоциации слабых кислот и оснований приведены в справочниках. Зная значение константы диссоциации и концентрацию растворенного электролита, можно вычислить степень диссоциации.
В неорганической химии чаще всего в качестве растворителя используется вода. Вода является слабым электролитом и диссоциирует с образованием ионов Н+ и ОН–:
Н2О ⇄ Н+ + ОН–.
Для чистой воды и разбавленных водных растворов электролитов произведение концентраций ионов водорода и гидроксид-ионов – величина постоянная, которая называется ионным произведением воды:
Kw
= CH
COH
COH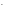 = 10–14
(22oC)
(7).
= 10–14
(22oC)
(7).
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением: