ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2225
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Количественные характеристики процесса гидролиза соли.
Количественными характеристиками процессов гидролиза являются степень гидролиза () и константа гидролиза (Кг).
Степень гидролиза ()отношение количества прогидролизовавшейся соли к общему количеству соли в растворе:
=
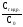 .
.
Константа гидролиза–константа равновесия процесса гидролиза.
Степень гидролиза () связана с константой гидролиза соли соотношением:
Кг
=
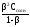 .
.
Если
1, то равенство упрощается:Кг
= 2Ссоли,
тогда =
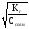 .
.
Упрощенной
формулой нельзя пользоваться,
если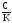 102.
102.
На величину степени гидролиза соли, кроме химической природы, влияют температура, концентрация соли и присутствие ионов Н+или ОН-.
Рассмотрим влияние указанных факторов на глубину протекания гидролиза на примере гидролиза соли Sn(NO3)2.
Запишем уравнение гидролиза соли (образованной слабым основанием и сильной кислотой):
Sn(NO3)2
+ H2O
![]() SnOHNO3
+ HNO3;
SnOHNO3
+ HNO3;
Sn2++H2O![]() SnOH++H+.
SnOH++H+.
Чтобы подавить гидролиз(уменьшить степень гидролиза) следует:
а) охладить раствор. Гидролиз (реакция, обратная нейтрализации) – эндотермический процесс. При нагревании, в соответствии спринципом Ле Шателье, гидролиз усиливается. Следует отметить также, что при нагревании Kw увеличивается в большей степени, чем константы диссоциации кислот и оснований.
б) увеличить концентрацию соли в растворе;
в) подкислить раствор, т.е. ввести ионы Н+, одноименные образующимся при гидролизе.
Чтобы усилить гидролизэтой соли, т.е. увеличить степень гидролиза следует:
а) повысить температуру;
б) разбавить раствор;
в) ввести в раствор ионы ОН-, которые нейтрализуют ионы Н+, образуя воду, т.е. подщелочить раствор.
1) Для средних солей, образованных слабой кислотой и сильным основанием, константа гидролиза рассчитывается по формуле:
Кг=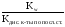 (Kw=
10-14– ионное произведение воды).
(Kw=
10-14– ионное произведение воды).
Например: Na2SO3 + H2O NaHSO3 + NaOH;
SO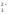 + H2O
+ H2O
![]() HSO
HSO + OH-;
+ OH-;
Кг
=
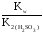 .
.
2) Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза рассчитывается по формуле:
Кг
=
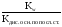 .
.
Например:
Ni(NO3)2
+ H2O
![]() NiOHNO3
+ HNO3;
NiOHNO3
+ HNO3;
Ni2++H2O![]() NiOH++H+;
NiOH++H+;
Кг=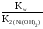 .
.
3) Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза рассчитывается по формуле:
Кг=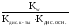 .
.
Например:
СН3СООNH4+H2O![]() СН3СООH+NH4OH;
СН3СООH+NH4OH;
Кг=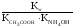 .
.
В растворах кислых солейдля определения рН раствора необходимо сопоставить соответствующие константы гидролиза и диссоциации кислотного остатка. Такое сопоставление показывает, что в растворе гидрокарбоната натрия рН7, тогда как в растворе гидросульфита натрия рН7.
Рассмотрим примеры задач, связанных с расчетами характеристик процессов гидролиза.
ПРИМЕР 1. Вычислить константу гидролиза, степень гидролиза и рН 0,1 М раствораNa2SO3.
РЕШЕНИЕ.
|
Na2SO3 |
NaOH– сильное основание H2SO3– слабая кислота |
2Na+
+ SO |
Гидролизу подвергается анион слабой кислоты:
SO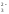 + H2O
+ H2O
![]() НSO
НSO + ОН-;
рН
7;
+ ОН-;
рН
7;
в молекулярной форме:
Na2SO3+H2O![]() NaНSO3+NaOH.
NaНSO3+NaOH.
Рассчитываем константу гидролиза:
Кг=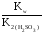 =
=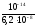 = 1,6110-7
= 1,6110-7
(К2
Н SO
SO = 6,210-8берем
из справочника).
= 6,210-8берем
из справочника).
=
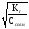 =
=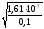 = 1,2710-3.
= 1,2710-3.
Для определения рН раствора нужно определить равновесную концентрацию ионов ОН-в растворе, образующихся в результате гидролизаNa2SO3:
СОН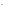 = С0или СОН
= С0или СОН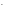 =
=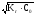 .
.
СОН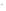 =
=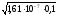 = 1,2710-4моль/л,
тогда
= 1,2710-4моль/л,
тогда
рОН
= -lgСОН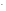 = -lg(1,2710-4) = -lg(1,27) –lg(10-4)
= -0,10 + 4 = 3,90;
= -lg(1,2710-4) = -lg(1,27) –lg(10-4)
= -0,10 + 4 = 3,90;
рН = 14 – рОН = 14 – 3,90 = 10,10.
ПРИМЕР 2. В растворе солиNH4СlpH= 5,13 рассчитать молярную концентрацию соли, степень и константу гидролиза.
РЕШЕНИЕ. Запишем диссоциацию соли:
|
NH4Сl |
NH4OH– слабое основание HСl – сильная кислота |
NH
|
Гидролизу подвергается катион слабого основания:
NH
 +H2O
+H2O![]() NH4OH
+H+;
NH4OH
+H+;
в молекулярной форме:
NH4Сl+H2O![]() NH4OH
+HСl.
NH4OH
+HСl.
Рассчитываем константу гидролиза:
Кг=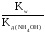 =
=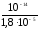 = 5,5610-10
= 5,5610-10
(Кд
NН OH= ,810-5 берем
из справочника). Используя формулу
СН
OH= ,810-5 берем
из справочника). Используя формулу
СН =
=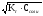 ,
найдем концентрацию соли, предварительно
по значению рН определим СН
,
найдем концентрацию соли, предварительно
по значению рН определим СН .
.
СН =
10-рН= 10-5,13= 7,410-6моль/л,
=
10-рН= 10-5,13= 7,410-6моль/л,
тогда
Ссоли=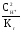 =
=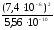 0,1 моль/л.
0,1 моль/л.
Степень гидролиза можно рассчитать исходя из формул:
=
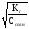 или=
или=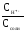 .=
.=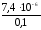 = 7,410-5.
= 7,410-5.
Комплексные соединения
Бинарные соединения типа H2O, NH3, SO2 и другие называют соединениями первого порядка. Более сложные вещества, полученные взаимодействием соединений первого порядка,называют соединениями высшего порядка.
Комплексными соединениями называются химические соединения высшего порядка, образованные взаимодействием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию в твердой, жидкой, газовой фазах. Чаще комплексообразование происходит в растворах.
Комплексные соединения состоят из центрального атома (комплексообразователя), вокруг которого координируются нейтральные молекулы или ионы – так называемые лиганды. Лиганды связаны с центральным атомом донорно-акцепторной связью и образуют вместе с ним внутреннюю сферу комплексного соединения. Суммарное число связей центрального атома с лигандами характеризует координационное число. Комплексообразователь и лиганды заключают в квадратные скобки. Например, в комплексном ионе [Fe(CN)6]4‑ катион Fe2+- комплексообразователь, ионы CN‑ - лиганды, координационное число = 6. Заряд комплексной часцицы равен алгебраической сумме зарядов ее составных частей. В том случае, если заряд внутренней координационной сферы > 0, комплексная часцица представляет собой комплексный катион. Ионы, компенсирующие заряд внутренней координационной сферы, находятся во внешней координационной сфере. Например, в хлориде диамминсеребра(I) [Ag(NH3)2]Cl имеется комплексный катион [Ag(NH3)2]+, а внешняя координационная сфера представлена хлорид-ионом. В том случае, если заряд внутренней координационной сферы < 0, комплексная часцица представляет собой анион. В составе гексацианоферрата(III) калия K3[Fe(CN)6] имеется комплексный анион [Fe(CN)6]3-, а внешняя координационная сфера представлена ионами калия.
Первую номенклатуру комплексных соединений разработалосновоположник координационной теории А. Вернер. По номенклатуре Вернера, или классической номенклатуре, для составления названия комплексного соединения используют следующие правила:
1. Называя комплексное соединение, сначала называют анион, а затем катион.
2. В названии аниона сначала указывают лиганды, а затем центральный атом.
3. Если лиганды различны по составу, то сначала называют отрицательно заряженные, затем нейтральные, а потом положительно заряженные лиганды.
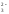
 + Сl -
+ Сl -