ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2196
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
|
NO MnO |
5 2 |
5NO + 5Н2О
+ 2MnO
+ 5Н2О
+ 2MnO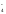 +
16H+
= 5NO
+
16H+
= 5NO + 10H+
+
2Mn2+
+ 8Н2О
+ 10H+
+
2Mn2+
+ 8Н2О
При наличии одинаковых частиц (ионов или молекул) в обеих частях суммарного ионно-молекулярного уравнения сократить их:
5NO + 2MnO
+ 2MnO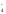 +
6H+
= 5NO
+
6H+
= 5NO + 2Mn2+
+ 3Н2О.
+ 2Mn2+
+ 3Н2О.
Полученные коэффициенты перенести в молекулярное уравнение:
5NaNO2 + 2KMnO4 + 3H2SO4 5NaNO3 + 2MnSO4 + K2SO4 + 3Н2О.
Чтобы написать уравнение ОВР, необходимо знать, как изменяются степени окисления элементов и в какие соединения превращается тот или иной окислитель или восстановитель. В зависимости от характера среды, концентрации растворов, температуры могут образовываться различные продукты ОВР.
Так,
в зависимости от характера среды
образуются различные продукты при
восстановлении перманганат-ионов MnO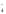 :
:
Кислая
среда (Н+)
Нейтральная среда (Н2О)
Щелочная среда (ОН–)
Например.
2KMnO4 + 5Zn + 8H2SO4 = 2MnSO4 + 5ZnSO4 + K2SO4 + 8Н2О
2KMnO4 + 3Na2SO3 + Н2О = 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + 3Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + Н2О.
Хром
со степенью окисления +6 существует в
форме аниона Cr2O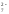 в кислой среде, в щелочной среде он
преобразуется в ион CrО
в кислой среде, в щелочной среде он
преобразуется в ион CrО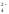 .
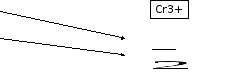
При восстановлении соединений хрома
(VI)
в кислой среде образуется катион Cr3+,
а в щелочной среде могут образовываться
различные соединения и ионы: [Cr(OH)6]3-,
CrО
.
При восстановлении соединений хрома
(VI)
в кислой среде образуется катион Cr3+,
а в щелочной среде могут образовываться
различные соединения и ионы: [Cr(OH)6]3-,
CrО ,Cr(OH)3
в зависимости от концентрации щелочи.
,Cr(OH)3
в зависимости от концентрации щелочи.
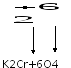
Кислая среда (Н+)
ОН- Н+
Щелочная среда (ОН–)
Например.
K2Cr2O7 + 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7Н2О
Окисление
соединений хрома со степенью окисления
+3 приводит к образованию CrО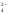 в щелочной среде иCr2O
в щелочной среде иCr2O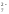 в кислой среде, например,
в кислой среде, например,
2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl + 8Н2О.
HNO3 окисляет большинство металлов и многие неметаллы. Благородные металлы (Au, Pt, Os, Ir) не реагируют с HNO3. Fe, Al, Cr не окисляются концентрированной азотной кислотой на холоду вследствие пассивации (образования на поверхности защитной оксидной пленки). При окислении металлы образуют нитраты, неметаллы окисляются до соответствующих высших кислот (Н3РО4, H2SO4, …), углерод – до СО2. При восстановлении HNO3 образуется смесь продуктов, в составе которых присутствует азот, при этом один из продуктов восстановления содержится в избытке. Его записывают в качестве продукта восстановления. Определяется продукт восстановления активностью металла и концентрацией кислоты:
N+4O2
N+2O
N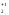 O
N
O
N N–3H3
(NH4NO3)
N–3H3
(NH4NO3)
активность
металла восстановителя увеличивается
HNO3
(конц.) HNO3
(разб.)
концентрация кислоты
уменьшается
Например:
Ag + 2HNO3(конц.) = AgNO3 + NO2 + H2O;
4Ca + 2HNO3(конц.) = 4Ca(NO3)2 + N2O + 5H2O;
4Mg + 10HNO3(разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O
H2SO4(разб.) подобно HCl и другим кислотам, реагирует с металлами, которые расположены в электрохимическом ряду напряжений до водорода, ионы Н+ при этом восстанавливаются до Н2:
Fe + H2SO4(разб.) = FeSO4 + Н2
H2SO4(конц.), как и HNO3, является кислотой – окислителем. H2SO4(конц.) реагирует также и с металлами, расположенными в электрохимическом ряду напряжений после водорода (Сu, Ag, Hg), с неметаллами. Не взаимодействуют с H2SO4(конц.) Au, Pt, Os, Ir; пассивируются на холоду Al, Cr, Fe. Продуктами восстановления H2SO4(конц.) могут быть:
S+4O2 S0 H2S-2
увеличение
активности восстановителя 
Например:
4Mg + H2SO4(конц.) = 4MgSO4 + H2S + 4H2O;
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O;
C + 2H2SO4(конц.) = CO2 + 2SO2 + 2H2O.
Галогены восстанавливаются в ОВР до галогенид-ионов, при восстановлении кислорода образуются продукты, степень окисления кислорода в которых –2:
Br2 + H2S = S + 2HBr,
O2 + 4Fe(OH)2 + 2H2O = 4Fe(OH)3
Кислородсодержащие кислоты галогенов и их соли обычно восстанавливаются до степени окисления –1, иногда до 0:
KClO3 + 6FeSO4 + 3H2SO4 = KCl + 3Fe2(SO4)3 + 3H2O;
HIO3 + 5HI = 3I2 + 3H2O.
К сильным окислителям относятся соединения PbO2, MnO2, восстанавливающиеся до соединений со степенью окисления атомов металла +2:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
Ионы металлов с более высокой степенью окисления (Fe+3, Co+3), выполняя функцию окислителей, восстанавливаются до ионов с более низкой степенью окисления: 2FeCl3 + H2S = 2FeCl2 + S + 2HCl. Ионы Н+ восстанавливаются до H2.
Металлы, как типичные восстановители, окисляются до соединений, содержащих атомы металлов в более высоких степенях окисления, в зависимости от природы металла и характера среды:
Mg + 2HCl = MgCl2 + H2;
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2.
Углерод окисляется кислородом до СО или СО2. При использовании углерода в качестве восстановителя в высокотемпературных процессах продуктом окисления, как правило, является СО вследствие протекания процесса
СО2 + С = 2СО.
Сера окисляется кислородом до SО2, фосфор – до Р2О3 или Р2О5, NO – до NO2, NН3, N2Н4 – до N2.
В ряду галогенид-ионов Г– восстановительные свойства усиливаются от Cl– к І–, в кислой среде происходит окисление до Г2:
KClO + 2KI + H2SO4 = I2 + KCl + K2SO4 + H2O.
Ионы металлов с более низкой степенью окисления (Fe+2, Cu+, Sn+2, …) при взаимодействии с окислителями окисляются до соединений, в которых их степени окисления более высокие:
5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + MnCl2 + KCl + 4H2O.
H2, являясь восстановителем, окисляется до ионов Н+. Гидрид-ионы Н– окисляются до H2:
СаН2 + 2H2O = Са(ОН)2 + 2H2.
Некоторые вещества, проявляют окислительно-восстановительную двойственность. Поэтому в присутствии окислителей с ярко выраженной окислительной способностью они проявляют восстановительные свойства, и наоборот:
окисление
восстановление Н2О
(кислая среда)
О2
Н2О2
ОН–
(щелочная среда)
окисление восстановление
NO NO
NO NO
NO


окисление восстановление
SO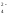 SO
SO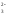 S.
S.
Электродные потенциалы
Для сравнения окислительно-восстановительных свойств окислителей и восстановителей используют стандартные электродные потенциалы. Наипростейший электрод представляет собой металлическую пластинку, опущенную в раствор соли этого же металла, например медная пластинка, опущенная в раствор CuSO4. Схематически электрод изображается следующим образом: записывают окисленную форму, потом через вертикальную черту, символизирующую границу межфазного раздела, восстановленную форму:
CuSO4/Cu или Cu2+/Cu.
Пластинка металла и раствор электролита составляют единую окислительно-восстановительную систему, в которой устанавливается равновесие между окисленной и восстановленной формой:
Cu2++
2ē
![]() Cu
или в общем виде Men++
nē
Cu
или в общем виде Men++
nē
![]() Me.
(1)
Me.
(1)
Если электрод изготовлен из активного металла и концентрация ионов металла в растворе меньше равновесной, то преобладает процесс перехода ионов металла в раствор, то есть равновесие (1) смещено влево. При этом металлическая пластинка заряжается отрицательно (Рис.А), так как электроны, образовавшиеся в процессе перехода ионов металла в раствор, остаются на пластинке (раствор не обладает электронной проводимостью). Гидратированные ионы металла притягиваются к отрицательно заряженной пластинке. Так образуется двойной электрический слой.

Если электрод изготовлен из неактивного металла, и металл опущен в раствор с концентрацией ионов большей, чем равновесная, равновесие (1) смещено вправо, то есть ионы металла будут переходить из раствора на металлическую пластинку. В этом случае поверхность металла заряжается положительно, а слой раствора возле пластинки – отрицательно (за счет избытка анионов в растворе) (Рис.В).
Количественными характеристиками указанных процессов являются электродные потенциалы, которые различаются по знаку и величине. Абсолютное значение электродного потенциала экспериментально определить невозможно. Можно определить разность потенциалов между двумя электродами, одним из которых является электрод сравнения. В качестве электрода сравнения, по отношению к которому определяют потенциалы других электродов, принят стандартный водородный электрод.
 + Н2О
– 2ē
= NO
+ Н2О
– 2ē
= NO + 2H+
+ 2H+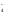 +
8H+
+ 5ē
= Mn2+
+ 4Н2О
+
8H+
+ 5ē
= Mn2+
+ 4Н2О