ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2170
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Примеры термодинамических расчетов
Задача1. Возможен ли при стандартных условиях процесс взаимодействия азота и кислорода воздуха?
Решение.
Значение G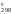 можно рассчитать двумя способами.
Записываем уравнение реакции с указанием
агрегатного состояния веществ. Подписываем
под формулой каждого вещества значения
H
можно рассчитать двумя способами.
Записываем уравнение реакции с указанием
агрегатного состояния веществ. Подписываем
под формулой каждого вещества значения
H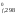 и S
и S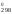 ,
G
,
G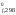 ,
взятые из справочника:
,
взятые из справочника:
(N2) + (O2) = 2(NO)
H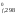 ,
кДж/моль 0 0 90,37
,
кДж/моль 0 0 90,37
S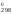 ,
Дж/(моль
К) 191,5 205,03 210,62
,
Дж/(моль
К) 191,5 205,03 210,62
G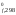 ,
кДж/моль 0 0 86,58.
,
кДж/моль 0 0 86,58.
1
способ.
Рассчитываем Н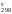 и S
и S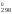 и приводим эти величины к одним единицам
измерения:
и приводим эти величины к одним единицам
измерения:
Н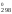 = 2H
= 2H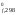 (NO)
– H
(NO)
– H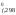 (O2)
– H
(O2)
– H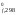 (N2)
= 2 90,37 – 0 – 0 = 180,74 кДж
= 180740 Дж;
(N2)
= 2 90,37 – 0 – 0 = 180,74 кДж
= 180740 Дж;
S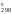 = 2S
= 2S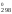 (NO)
– S
(NO)
– S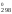 (O2)
– S
(O2)
– S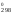 (N2)
= 2
210,62 – 205,03 – 191,5 = 24,71 Дж/К.
(N2)
= 2
210,62 – 205,03 – 191,5 = 24,71 Дж/К.
G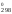 = Н
= Н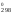 – ТS
– ТS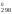 = 180 740 – 298
24,71 = 173 376 Дж = 173,376 кДж.
= 180 740 – 298
24,71 = 173 376 Дж = 173,376 кДж.
2 способ. Изменение энергии Гиббса в ходе реакции можно также рассчитать, зная величины изменения энергии Гиббса образования веществ, участвующих в химическом процессе, по формуле
G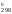 = 2G
= 2G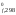 (NO)
– G
(NO)
– G (N2)
– G
(N2)
– G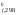 (O2)
= 2 86,58 – 0 – 0 = 173,16 кДж.
(O2)
= 2 86,58 – 0 – 0 = 173,16 кДж.
Полученное значение практически совпадает с рассчитанным первым способом.
Так
как G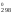
0, то процесс невозможен при стандартных
условиях.
0, то процесс невозможен при стандартных
условиях.
Взаимосвязь стандартной энергии Гиббса и константы равновесия выражается уравнением
G = –RTlnKp.
= –RTlnKp.
Пример 2. Определите давление разложения 3[Fe2O3] ⇄ ⇄ 2[Fe3O4] + ½(O2) при 627оС. При какой температуре давление кислорода достигнет 1 атм (101 325 Па)?
Решение.
Для определения давления разложения,
т. е. давления кислорода, который
образуется в данном процессе термического
разложения, надо вычислить Кр
= р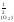 при Т
= 627оС
= = 900 К.
при Т
= 627оС
= = 900 К.
Запишем
процесс и для всех веществ, участвующих
в реакции, выписываем из справочника
значения H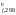 и S
и S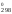 :
:
3[Fe2O3] ⇄ 2[Fe3O4] + ½(O2)
H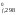 ,кДж/моль
–821,22 –1117,71 0
,кДж/моль
–821,22 –1117,71 0
S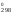 ,
Дж/(моль
К) 89,96 151,46 205,03.
,
Дж/(моль
К) 89,96 151,46 205,03.
В соответствии со следствием из закона Гесса:
Н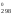 = 2H
= 2H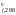 [Fe3O4]
+ ½
H
[Fe3O4]
+ ½
H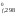 (O2)
– 3H
(O2)
– 3H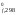 [Fe2O3]
= = 2
(–1117,71) + ½
0 – 3(–821,22) = 228,54 кДж = 228 540 Дж;
[Fe2O3]
= = 2
(–1117,71) + ½
0 – 3(–821,22) = 228,54 кДж = 228 540 Дж;
S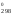 = 2
S
= 2
S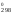 [Fe3O4]
+ ½
S
[Fe3O4]
+ ½
S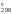 (O2)
– 3S
(O2)
– 3S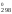 [Fe2O3]
= 2
151,46 + + ½
205,03 – 3
89,96 = 135,555 Дж/К.
[Fe2O3]
= 2
151,46 + + ½
205,03 – 3
89,96 = 135,555 Дж/К.
Изменение стандартной энергии Гиббса при 900 К находим из соотношения:
Н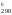 – ТS
– ТS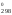 ,
(Н
,
(Н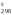
Н
Н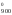 ,
S
,
S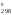
S
S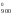 ).
).
G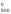 = Н
= Н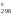 – 900S
– 900S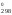 = 228 540 – 900
135,555 = 106 540,5 Дж.
= 228 540 – 900
135,555 = 106 540,5 Дж.
lgKp
=
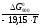 =
=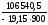 = –6,1816;Kp
=
6,583
10–7.
= –6,1816;Kp
=
6,583
10–7.
Для
данного гетерогенного процесса Кр
= р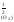 ,
отсюда
,
отсюда
Р(О )
= (Kp)2
= 4,334
10–13
атм.
)
= (Kp)2
= 4,334
10–13
атм.
Если давление кислорода равно 1 атм то
lgKp
= lg1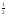 =lg1
= 0 и G
=lg1
= 0 и G = –19,15
Т
lgКp
= 0.
= –19,15
Т
lgКp
= 0.
Найдем
температуру, при которой G = 0:
= 0:
G = Н
= Н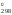 – ТS
– ТS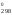 = 0, отсюда
= 0, отсюда
Т
=
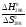 =
=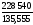 = 1686 К.
= 1686 К.
Следовательно, при температуре 1686 К, когда давление кислорода равно внешнему (1 атм), начнется разложение Fe2O3.
Пример
3.
Определить термодинамические
характеристики H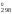 и S
и S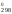 процесса испарения бромида олова (II).
Давление насыщенного пара SnBr2
при температуре 516оС
составляет 0,13 атм, а при 636оС
– 1 атм.
процесса испарения бромида олова (II).
Давление насыщенного пара SnBr2
при температуре 516оС
составляет 0,13 атм, а при 636оС
– 1 атм.
Решение.
Для процесса {SnBr2}
⇄ (SnBr2)
Kр
= РSnBr .
Константы равновесия связаны с
термодинамическими характеристиками
при разных температурах соотношениями:
.
Константы равновесия связаны с
термодинамическими характеристиками
при разных температурах соотношениями:
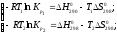
Kp = Р1
SnBr
= Р1
SnBr = 0,13 атм, Kp
= 0,13 атм, Kp = Р2
SnBr
= Р2
SnBr = 1 атм.
= 1 атм.
T1
= 516 + 273 = 789 К, T2
= 909 К. Так как ln1
= 0, то из второго уравнения можно выразить
H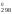 через S
через S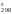 (H
(H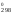 = 909S
= 909S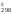 )
и подставить в первое уравнение:
)
и подставить в первое уравнение:
–8,314
789
ln0,13 = 909S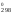 – 789S
– 789S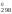 = 120S
= 120S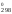 ;
;
S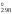 =
=
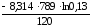 = 111,55 Дж/К.
= 111,55 Дж/К.
Тогда
H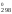 = 909S
= 909S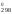 = 909
111,55 = 101 400 Дж
= 101,4 кДж.
= 909
111,55 = 101 400 Дж
= 101,4 кДж.
Полученные значения h и s характеризуют процесс испарения SnBr2. Процесс эндотермический, испарение требует нагревания. При испарении энтропия увеличивается.
Пример 4. Диссоциация нитрозилхлорида происходит по схеме 2(NOCl) = 2(NO) + (Cl2). Определить, при какой температуре Kр этой реакции равна 1. Чему равно парциальное давление Cl2, если общее давление в системе при равновесии составляет 2 атм?
Решение.
Запишем
уравнение реакции. Для каждого вещества,
участвующего в ней, выпишем из справочника
значения H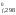 и S
и S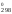
2(NOCl) = 2(NO) + (Cl2)
H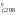 ,
кДж/моль 52,5 90,25 0
,
кДж/моль 52,5 90,25 0
S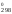 , Дж/(моль
К) 261,5 210,62 222,9.
, Дж/(моль
К) 261,5 210,62 222,9.
Рассчитаем
Н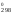 и S
и S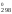 :
:
Н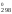 = 2
90,25 + 0 – 2
52,25 = 75,5 кДж = 75 500 Дж;
= 2
90,25 + 0 – 2
52,25 = 75,5 кДж = 75 500 Дж;
S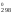 = 2
210,62 + 222,9 – 2
261,5 = 121,14 Дж/К.
= 2
210,62 + 222,9 – 2
261,5 = 121,14 Дж/К.
Из
равенства Н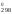 – 298
S
– 298
S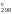 = –R
298
lnKp
= 0 с учетом допущения о независимости
значений Н
= –R
298
lnKp
= 0 с учетом допущения о независимости
значений Н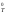 и S
и S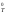 от температуры
от температуры
рассчитаем искомую температуру, при которой Kp = 1 (ln1 = 0):
Т
=
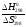 =
=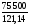 = 623,2 К.
= 623,2 К.
Для
расчета парциального давления хлора
(pCl )
нужно использовать константу равновесия
указанного процесса Кр
и закон Дальтона.
)
нужно использовать константу равновесия
указанного процесса Кр
и закон Дальтона.
Кр
процесса имеет вид: Кр
=
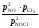 .
На основании закона ДальтонаРобщ
= рNOCl
+ pNO
+ pCl
.
На основании закона ДальтонаРобщ
= рNOCl
+ pNO
+ pCl .
.
Если
парциальное давление хлора принять за
х,
то парциальное давление NO
составит 2х,
так как из уравнения реакции следует,
что в состоянии равновесия на 1 моль
хлора образуется 2 моля NO,
поэтому парциальные давления компонентов
Cl2
и NO
тоже будут относиться как 1:2 (pNO
= 2pCl = 2х).
= 2х).
Парциальное
давление рNOCl
можно выразить через парциальные
давления pCl и pNO:
и pNO:
рNOCl
= Робщ
– (pNO
+ pCl )
= 2 – 3х.
)
= 2 – 3х.
Выражение константы равновесия запишется:
Kр
=
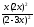 = 1; 1 =
= 1; 1 =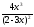 .
.
Решая уравнение относительно х, получим х = 0,4595.
pCl = 0,4595 атм.
= 0,4595 атм.
Химическая кинетика. Скорость химической реакции
Методы и приемы химической термодинамики позволяют выяснить лишь принципиальную возможность осуществления химической реакции, условия ее вероятного протекания, определить полноту превращения реагирующих веществ в продукты реакции. Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх < 0), а концентрации продуктов реакции увеличиваются (ΔСпрод > 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
![]()