ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2169
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
S
O = P – O – Fe – O – P = O 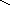
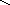
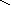
H–O–Fe–OOO–HH–O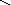
Энергетика химических реакций
Химическая термодинамика - это область химии, изучающая химические реакции, фазовые переходы, а также превращения энергии в различных химических процессах, направление и пределы их самопроизвольного протекания.
Основным объектом изучения термодинамики является система, под которой понимают совокупность объектов, отделенную от всех других, которая подвергается теоретическому или экспериментальному изучению. Внешняя среда – объекты, окружающие систему. Границы между системой и внешней средой могут быть как физически действительными, так и условными.
Система бывает:
открытой, если через границу, разделяющую систему и внешнюю среду, может происходить обмен веществом и энергией (например, жидкость и ее пар).
закрытой, если она может обмениваться с внешней средой энергией и не может обмениваться веществом (например, газ в баллоне).
изолированной, есистема не в состоянии обмениваться в внешней средой ни веществом, ни энергией. (например, запаянная ампула, полностью изолированная от внешней среды).
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения (указанные формы могут превращаться друг в друга). В превращениях, протекающих в ходе химических реакций, участвуют, как правило, тепловая энергия Q и механическая (или работа) А. Теплота и работа измеряются в джоулях (Дж), килоджоулях (кДж), мегаджоулях (МДж) и т.д.
При протекании химических реакций изменяется энергетическое состояние системы, в которой идет эта реакция. Состояние системы определяется параметрами состояния (давление (р), температура ( Т ), объем ( V ), химическое количество вещества (п ), состав системы и др.). Экстенсивные параметры зависят от количества вещества, находящегося в системе (масса, оъем, энергия). Интенсивные параметры не зависят от количества вещества, находящегося в системе (температура, плотность, давление). Состояние системы и происходящие в ней изменения характеризуются функциями состояния (внутренняя энергия (U), энтальпия (Н ), энтропия (S), энергия Гиббса (G ) и др.), зависящими от параметров состояния системы и не зависящих от пути перехода системы из одного состояния в другое.
В термодинамике свойства системы рассматриваются при ее равновесном состоянии. Термодинамическое состояние системы называют равновесным в том случае, когда его термодинамические параметры одинаковы во всех точках системы и не изменяются самопроизвольно (без затраты работы) во времени.
Термодинамика изучает переходы системы из одного состояния в другое. Но переходы должны осуществляться при термодинамическом равновесии с окружающей средой, т.е. очень медленно, а в идеале - бесконечно медленно. При этом могут изменяться все параметры состояния системы, либо некоторые параметры остаются без изменения. Если процессы перехода системы происходят при постоянстве каких-то параметров системы, то они называются:
а) изобарическими (р = const);
б) изохорическими (V= const);
в) изотермическими (Т= const);
г) изобарно-изотермическими (р = const, Т= const) и т.д.
Под внутренней энергией системы (U) в термодинамике понимают ее полную энергию, которая складывается из энергии поступательного, колебательного и ·вращательного движения, энергии притяжения и отталкивания всех частиц системы, исключая потенциальную энергию ее положения и кинетическую энергию движения системы как целого. Поскольку не определен условный нуль для внутренней энергии, то установить можно лишь ее изменение как разность значений внутренней энергии системы в конечном U2 и начальном U1 состоянии, т.е.
ΔU = U2 – U1 ,
где U2 и U1 - внутренняя энергия системы в конечном и начальном состояниях.
Если в ходе химической реакции внутренняя энергия системы понижается (ΔU < О ), то происходит выделение некоторого количества теплоты во внешнюю среду (экзотермическая реакция). Если же внутренняя энергия системы повышается (ΔU > 0), то реакционная система поглощает энергию из внешней среды (эндотермическая реакция). Чем больше изменение внутренней энергии, тем значительнее по величине тепловой эффект реакции.
Изменение внутренней энергии можно измерить с помощью работы и теплоты, так как система может обмениваться с окружающей средой веществом или энергией в форме теплоты Q и работы А.
Теплота Q представляет собой количественную меру хаотического движения частиц данной системы или тела. Энергия более нагретого тела в форме теплоты передается менее нагретому телу. При этом не происходит переноса вещества от одной системы к другой или от одного тела к другому.
Работа А является количественной мерой направленного движения частиц, мерой энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой под действием тех или иных сил, например гравитационных.
Положительной (А > О) считается работа, совершаемая системой против действия внешних сил, и теплота (Q > О), подводимая к системе. В отличие от внутренней энергии, работа и теплота зависят от способа проведения процесса, т.е. они являются функциями пути.
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:
Q = ΔU + А (1)
Выражение (1) означает, что теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.
Первый закон термодинамики является формой выражения закона сохранения энергии. Согласно этому закону, энергия не может ни создаваться, ни исчезать, но может превращаться из одной формы в другую.
Энтальпия системы и ее изменение. Работу А можно разделить на два слагаемых: работу расширения pΔV (p = const) и другие виды работ A', кроме работы расширения:
А= А' + pΔV, (2)
где р - внешнее давление; ΔV - изменение объема (ΔV = V2 – V1); V2 - объем продуктов реакции; V1 - объем исходных веществ. Соответственно уравнение (1) при постоянном давлении запишется в виде:
Qp = ΔU + А' + pΔV . (3)
Если на систему не действуют никакие другие силы, кроме постоянного давления, т.е. при протекании химического процесса единственным видом работы является работа расширения, то А' =0.
в этом случае уравнение (3) запишется:
Qp = ΔU + pΔV (4)
Подставив ΔU = U2 – U1 получим:
Qp = U2 – U1 + pV2 - pV1 = (U2 + pV2) - (U1 + pV]). (5)
Характеристическая функция
U + pV =Н (6)
называется энтальпией системы. Энтальпия – теплосодержание, т.е. количество теплоты, которое необходимо придать системе, чтобы перевести ее от абсолютного нуля (Т=0 К) до заданной температуры. Энтальпия - одна из термодинамических функций, характеризующих систему, находящуюся при постоянном давлении. Подставив уравнение (6) в (5), получим:
Qp = Н2 – Н1 = ΔН. (7)
Как видно из уравнения (7), в случае изобарического процесса (р= const), теплота, подведенная к системе, равна изменению энтальпии системы. Как и другие характеристические функции, энтальпия зависит от количества вещества, поэтому ее изменение (ΔН), обычно относят к 1 моль и выражают в кДж/моль.
Изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения, называется тепловым эффектом химической реакции (энтальпией реакции).
Если система находится в изохорических условиях (V= const, ΔV= 0), то из уравнения (3) следует:
Qv= ΔU, (8)
Т.е. в этом случае тепловой эффект химической реакции равен изменению внутренней энергии системы.
Поскольку в большинстве случаев химические реакции протекают при постоянном давлении, то в дальнейшем, кроме особо оговоренных исключений, будут рассмотрены изобарические условия. Тепловой эффект реакции будем называть также энтальпией реакции и обозначать ΔН. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то тепловой эффект реакции называется стандартной энтальпией реакции обозначается ΔНо. За стандартное состояние вещества принимают такое его физическое состояние, в котором чистое вещество наиболее устойчиво при давлении 1 атм и определенной температуре. Температура может быть любой постоянной, но чаще всего это 298 К.
Условия стандартного состояния веществ
|
Состояние вещества |
Стандартное состояние вещества |
|
Простое твердое вещество |
Кристаллическое твердое вещество |
|
Простое жидкое вещество |
Чистая жидкость |
|
Газообразное |
Парциальное давление 101, 325 кПа (1 атм) |
|
Растворенное |
Концентрация·· 1 моль/л (активность 1 моль/л) |