ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2160
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
В случае взаимодействия нейтральных молекулпродукт реакции (например bf3∙nh3) часто называют аддуктом.
Р-ции между кислотамииоснованиямиЛьюиса иллюстрируют следующие, примеры:
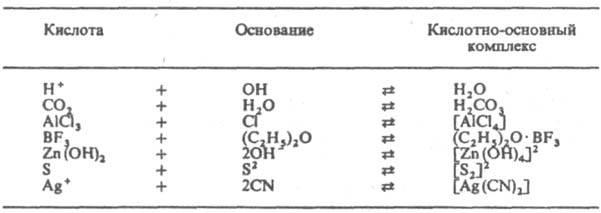
Понятие основанияв теориях Льюиса и Брёнстеда-Лоури совпадают, однако понятие кислоты в первой теории охватывает, кромепротона, также электроноакцепторные вещества, в обратимых реакциях которых соснованиямине участвуетводород, напр. BF3, SO3, Ag+. К кислотам Льюиса относится протон, как частица, легко присоединяющаяпаруэлектронов. Протонные кислоты рассматриваются в теории Льюиса как продуктынейтрализациипротонаоснованиями(напр., соляная кислота ‑ продуктнейтрализацииН+ основаниемСl− ). Растворениекислот Льюиса в ионизирующих растворителях приводит к ростуконцентрациикатионоврастворителя (напр., SO3+Н2О=Н3О++HSO4−). Основанияже увеличиваютконцентрациюанионоврастворителя [напр., (CH3)3N+H2O=ОН−+(CH3)3NH+]. Кислоты и основанияЛьюиса невозможно расположить в универсальный ряд по силе, т.к. их последовательность зависит от вещества, взятого за стандарт для сравнения.
Теория сольвосистем
В 1905 г. В. Франклином была предложена теория, получившая название теории cольвосистем. Теория cольвосистем была применима к водоподобным самоионизирующимся растворителям и по существу не отличалась от теории кислот и оснований теории Аррениуса. Согласно теории cольвосистем, кислота – это вещество, образующее катион, идентичный с катионом растворителя. Основание – это вещество, образующее анион, идентичный с анионом растворителя. Так, в случае аммосистем растворитель – NH3, самоионизирующийся по реакции:
2NH3
![]() NH4+
+ NH2–
NH4+
+ NH2–
KNH2
![]() K+
+ NH2–,
K+
+ NH2–,
KNH2 является основанием, а NH4Cl – кислотой:
NH4Cl
![]() NH4+
+ Cl–.
NH4+
+ Cl–.
Реакция нейтрализации, как и по теории Аррениуса, сводится к образованию растворителя и соли:
KNH2
+ NH4Cl
![]() 2NH3
+ KCl.
2NH3
+ KCl.
Образование соли в результате кислотно-основного взаимодействия послужило поводом к названию этих систем – cольвосистемы. Каждаясольвосистема имеет свой круг кислот и оснований, свою шкалу кислотности, свою реакцию нейтрализации и т.д. Исторически теория cольвосистем сыграла важную роль в накоплении опытных данных по химии неводных самоионизирующихся растворителей. В настоящее время эта теория утратила свое значение.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции (ОВР) – это реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Изменение степеней окисления атомов элементов может происходить только в результате перехода электронов от одного атома к другому.
Процесс отдачи электронов называется окислением. В процессе окисления степень окисления атома элемента повышается. Процесс присоединения электронов называется восстановлением. В процессе восстановления степень окисления атома элемента понижается. Процессы окисления и восстановления сопряжены, процесс окисления всегда сопровождается процессом восстановления, а процесс восстановления – окислением.
Восстановителями называют атомы, молекулы или ионы, которые отдают электроны в процессе окисления. Восстановители в ОВР окисляются.
Окислителями называют атомы, молекулы или ионы, которые присоединяют электроны в процессе восстановления. Окислители в ОВР восстанавливаются.
В периодах периодической системы слева направо увеличивается окислительная способность атомов элементов, уменьшается их восстановительная способность. В главных подгруппах сверху вниз усиливается восстановительная способность атомов элементов и уменьшается их окислительная способность. Наиболее активными восстановителями являются металлы I и II групп, наиболее активными окислителями – неметаллы VI и VII групп (кислород, озон, галогены) (табл. 1).
Таблица 1. Наиболее важные восстановители и окислители
|
Восстановители |
Окислители |
|
Металлы; H2S, SO2, H2SO3, сульфиты; HI, HBr, HCl; NH3, N2H4 (гидразин), HNO2, NO; РН3 (фосфин), Н3РО3; Соли: SnCl2, FeSO4, MnSO4, Cr2(SO4)3.
|
Галогены, О2, О3; KMnO4, K2MnO4; K2Cr2O7, K2CrO4; Кислоты-окислители: HNO3, H2SO4(конц.), H2SeO4, HMnO4, «царская водка»; Оксиды металлов: PbO2, MnO2, CrO3, Ag2O, CuO; FeCl3; гипохлориты, хлораты, перхлораты; Ионы неактивных металлов: Ag+, Au3+. |
Типы окислительно-восстановительных реакций приведены в табл.2.
Таблица 2. Типы ОВР
|
Тип ОВР |
Примеры реакций |
Особенности реакций |
|
Межмоле-кулярные |
2KMn+7O4
+
10KI-1
+
8H2SO4
=
=2Mn+2SO4
+5I Fe |
Реакции происходят с изменением степени окисления атомов в молекулах разных веществ |
|
Внутримо-лекулярные |
2KCl+5O 2NaN+5O |
Реакции происходят с изменением степе-ни окисления атомов в одной молекуле |
|
Самоокис-ления-самовосста-новления (диспро-порциони-рования) |
Cl 3K2Mn+6O4+2H2O=2KMn+7O4+ +Mn+4O2+4KOH 2N+4O2+2KOH=KN+5O3+KN+3O2++H2O |
Реакции происходят с изменением степе-ни окисления одина-ковых атомов в моле-куле одного и того же вещества |
Расстановку коэффициентов в ОВР можно осуществить: 1) методом электронного баланса (для твердофазных реакций, реакций в газовой фазе, в растворах); 2) методом ионно-электронного
баланса, или методом полуреакций (для реакций в растворах).
При расстановке коэффициентов методом электронного баланса придерживаются следующих правил:
Записывают формулы исходных веществ, продуктов реакции и побочных продуктов химической реакции. Определяют элементы, атомы которых изменили свои степени окисления:
KMn+7O4 + Na2S+4O3 + H2SO4 Mn+2SO4 + Na2S+6O4 + K2SO4 + H2O
-
Записывают уравнения электронного баланса, указывают окислитель и восстановитель. В уравнения записывают условные частицы (иногда реальные), заряд которых определяют исходя из правил определения степеней окисления:
восстановитель S+4 –2ē = S+6
окислитель Mn+7 +5ē = Mn+2
5 (процесс окисления)
2 (процесс восстановления)
Для установления баланса по электронам (число электронов, отданных восстановителем, равно числу электронов, принятых окислителем) полученные электронные уравнения умножают на наименьшие множители (соответственно 5 и 2 в приведенном примере).
Полученные коэффициенты переносят в уравнение реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O.
Если окисляемое вещество содержит два восстановителя, определяется общее число отданных электронов:
Fe+2S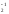 + O
+ O
Fe2O
Fe2O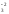 + S+4O
+ S+4O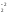
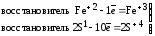 4
(процесс окисления)
4
(процесс окисления)
окислитель
O +4ē
= 2О–2
11 (процесс восстановления)
+4ē
= 2О–2
11 (процесс восстановления)
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Ионно-электронный
метод расстановки
коэффициентов применяют при написании
реакций, протекающих в растворе. При
написании полуреакций окисления и
восстановления этим методом используются
символы частиц, реально существующих
в растворе: MnO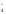 ,
SO
,
SO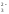 ,
SO
,
SO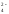 .
Слабые электролиты, малорастворимые
соли и газообразные вещества в таких
уравнениях записывают в виде молекул,
сильные электролиты – в виде ионов.
.
Слабые электролиты, малорастворимые
соли и газообразные вещества в таких
уравнениях записывают в виде молекул,
сильные электролиты – в виде ионов.
Ионно-электронный метод удобно использовать для реакций с участием веществ, в которых трудно определить степени окисления, например KCNS. Ионно-электронные схемы составляются по-разному в зависимости от характера среды, в частности по-разному выполняют баланс по кислороду (табл.3).
Таблица 3. Выполнение баланса по кислороду
|
рН |
Части-цы раство-ра |
Последовательность сос-тавления полуреакций окисления и восстановле-ния . |
Примеры |
|
7 (кислая среда) |
Н+, Н2О |
В ту часть полуреакции, в которой не достает кисло-рода, нужно записать молекулу воды на каждый недостающий атом кисло-рода, в противоположную часть – количество ионов Н+, необходимое для соблюдения материаль-ного баланса |
NO NO |
|
7 (щелоч-ная среда) |
ОН–, Н2О |
В ту часть полуреакции, в которой не хватает кисло-рода, нужно записать по две группы ОН– на каж-дый недостающий атом кислорода, в противопо-ложную часть – необхо-димое для материального баланса число молекул Н2О |
MnO S+8ОН–
SO |
Главные этапы составления уравнений реакций ионно-электронным методом:
Записать формулы веществ, участвующих в химической реакции:
NaNO2 + KMnO4 + H2SO4 NaNO3 + MnSO4 + K2SO4 + Н2О
Записать полуреакции окисления и восстановления. Уравнять число атомов всех элементов, кроме водорода и кислорода.
Уравнять кислород с использованием молекулы воды и ионов Н+ или ОН– в зависимости от среды (см.табл.3).
Уравнять число атомов водорода в левой и правой частях уравнения, используя ионы Н+ или ОН– и Н2О (в зависимости от среды).
Уравнять суммарные заряды ионов левой и правой частей уравнения, прибавляя или вычитая электроны.
Определить числа (множители), на которые необходимо умножить каждую из частиц соответствующих полуреакций и просуммировать полуреакции.
 +6K2SO4+8H2O
+6K2SO4+8H2O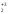 O3
+ 3H
O3
+ 3H = 2Fe0
+ 3H2O
= 2Fe0
+ 3H2O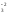
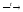 2KCl–1
+ O
2KCl–1
+ O
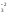
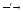 2NaN+3O2+
O
2NaN+3O2+
O
 +2NaOH=NaCl-1+NaCl+1O+
+ H2O
+2NaOH=NaCl-1+NaCl+1O+
+ H2O +4H+NO+2Н2О
+4H+NO+2Н2О +Н2ОNO
+Н2ОNO +2H+
+2H+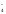 +2Н2ОMnO2
+
+ 4ОН–
+2Н2ОMnO2
+
+ 4ОН–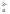 +4Н2О
+4Н2О