ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2177
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
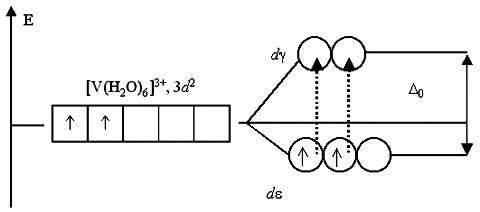
Существует всего два варианта перехода двух электронов на d-подуровень: либо оба электрона занимают d-АО, либо только один из них. Любые другие переходы электронов, связанные с уменьшением суммарного спина, запрещены. Указанным переходам электронов, получивших избыточную энергию, соответствует полоса поглощения около 400 нм в спектре поглощения раствора хлорида гексаакваванадия(III). Поглощение пурпурно-фиолетовой области спектра дает дополнительный цвет раствора – ярко-зеленый.
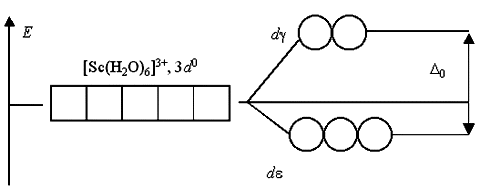
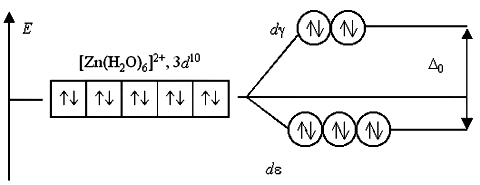
Если комплексообразователь имеет электронную конфигурацию d0 или d10, то переходы электронов с d- на d-подуровень или наоборот невозможны либо из-за отсутствия электронов, либо из-за отсутствия вакантных орбиталей. Поэтому растворы комплексов с такими комплексообразователями, как Sc(III), Cu(I), Zn(II), Cd(II) и т.п., не поглощают энергии в видимой части спектра и кажутся бесцветными:
Избирательность поглощения света зависит не только от комплексообразователя и степени его окисления, но и от вида лигандов. При замене в комплексном соединении лигандов, находящихся в левой части спектрохимического ряда, на лиганды, создающие сильное электростатическое поле, наблюдается увеличение доли энергии, поглощаемой электронами из проходящего света и как следствие – уменьшение длины волны соответствующей полосы поглощения. Так, водный раствор, содержащий катионы тетрааквамеди(II) [Cu(H2O)4]2+, окрашен в голубой цвет, а раствор сульфата тетраамминмеди(II) [Cu(NH3)4]2+ имеет интенсивно синюю окраску.
|
|