ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2193
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
![]()
Вшкале электроотрицательности по Полингуэлектроотрицательность фтора принчта равной 4,0. Электроотрицательностьэлементов уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведены относительные электроотрицательности некоторых элементов.
|
|
Li |
Be |
B |
C |
N |
O |
F |
|
ЭО |
1,0 |
1,5 |
2,0 |
2,5 |
3,1 |
3,5 |
4,0 |
|
|
Na |
K |
Rb |
Cs |
|
ОЭО |
0,9 |
0,8 |
0,8 |
0,7 |
|
|
Cl |
Br |
I |
|
ОЭО |
3,0 |
2,8 |
2,6 |
Наибольшее значение электроотрицательности имеет фтор, наименьшее –цезий.Водородзанимает промежуточное положение, т.е. при взаимодействии с одними элементами (например, сF) он отдает электрон, а при взаимодействии с другими (например, сRb) – приобретает электрон.
Строго говоря, элементу нельзя приписать постоянное значение электроотрцательности. Она зависит от валентного состояния элемента, типа соединения, в которое он входит и др.
г) Окислительно-восстановительные свойстванейтральных атомов. Эти свойства определяются значениями энергии ионизацииисродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, принимающий электрон. В периоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается. Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями в изменении сродства к электрону.
д) Кислотно-основные свойствасоединений. Свойства оксидовигидроксидовэлементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее,степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
|
Na+ |
Mg2+ |
Al3+ |
Si4+ |
P5+ |
S6+ |
Cl7+ |
||||
|
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
||||
|
NaOH |
Mg(OH)2 |
Al(OH)3 |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
||||
|
основные
|
амфотерный |
слабо кислотный |
средне кислотный |
сильно кислотные
|
||||||
Сверху вниз в подгруппе при одинаковости заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются:
|
B3+ |
H3BO3 |
слабая кислота |
|
Al3+ Ga3+ In3+ |
Al(OH)3 Ga(OH)3 In(OH)3 |
амфотер- ные гидрок- сиды |
|
Tl3+ |
Tl(OH)3 |
более выражены основные свойства |
Аналогичный пример можно привести для кислородсодержащих кислот элементов VI группы: сила кислот убывает в ряду:
H2SO4 ‑ H2SeO4 ‑ H2TeO4.
Ковалентная связь. Метод валентных связей

Образование ковалентной связиможно рассматривать в рамках двух методов квантовой химии:метода валентных связейиметода молекулярных орбиталей.
В 1916 г. американский ученый Льюисвысказал предположение о том, чтохимическая связьобразуется за счет обобществления двухэлектронов. При этом электронная оболочкаатомастремится по строению к электронной оболочкеблагородного газа. В дальнейшем эти предположения послужили основой для развитияметода валентных связей. В 1927 г. ГайтлеромиЛондономбыл выполнен теоретический расчет энергии двух атомовводородав зависимости от расстояния между ними. Оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знакуспинывзаимодействующих электронов. При совпадающем направлении спинов сближение атомов приводит к непрерывному возрастанию энергии системы. При противоположно направленных спинах на энергетической кривой имеется минимум, т.е. образуется устойчивая система – молекула водорода Н2 (рисунок 1).
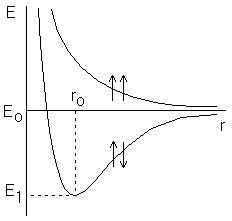
Рисунок. 1 – Зависимость энергии от расстояния между атомами водорода при однонаправленных и противоположно направленных спинах.
Межъядерное расстояние r0, соответствующее минимуму, называется длиной связи, а энергия связи равна глубине потенциальной ямы E0–E1, где Е0 – энергия двух невзаимодействующих атомов, находящихся на бесконечном расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность отрицательного заряда в межъядерном пространстве возрастает, и положительно заряженныеядрапритягиваются к этой области. Такая химическая связь называется ковалентной.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей(метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
3. Связь располагается в направлении, обеспечивающем наибольшую степень перекрывания электронных орбиталей.
Комбинации двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. Примеры построения валентных схем:
![]()

В валентных схемах наиболее наглядно воплощены представления Льюисаоб образовании химической связи путем обобществления электронов с формированием электронной оболочки благородного газа: дляводорода– из двух электронов (оболочкаHe), дляазота– из восьми электронов (оболочкаNe).


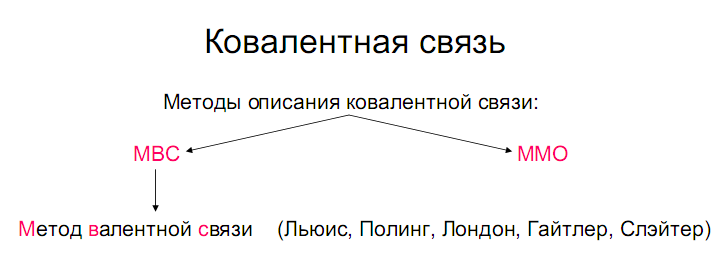
Свойства ковалентной связи: насыщаемость, направленность и поляризуемость.
Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталейв атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможнуювалентностьэлемента. Число уже использованных для этогоорбиталейопределяет валентность элемента в данном соединении.
|
|
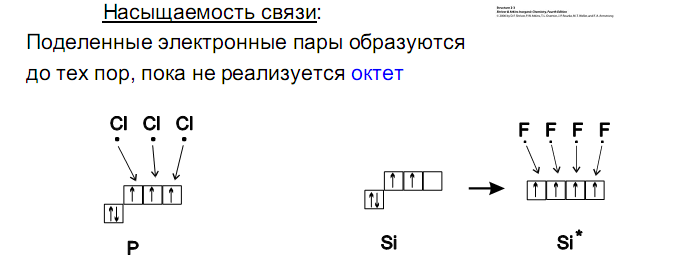
Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотностимежду ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляютs-электронные облака, поскольку их сферическая форма делает все направления равноценными. Дляp- и d-электронных облаковперекрывание осуществляется вдоль оси, по которой они вытянуты, а образующаяся при этом связь называетсяσ-связью. σ -Связь имеет осевую симметрию, и оба атома могут вращаться вдоль линии связи, т.е. той воображаемой линии, которая проходит через ядра химически связанных атомов.
После образования между двумя атомами σ -связи для остальных электронных облаков той же формы и с тем же главным квантовым числомостается только возможность бокового перекрывания по обе стороны от линии связи. В результате образуется p-связь. Она менее прочна, чем σ -связь: перекрывание происходит диффузными боковыми частями орбиталей.
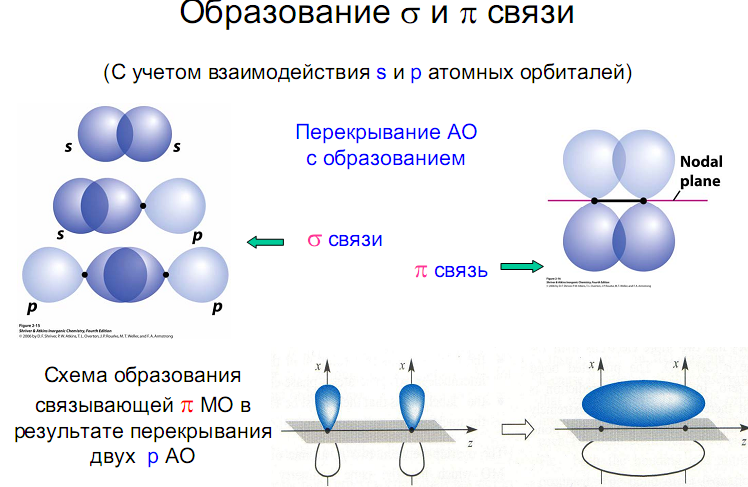
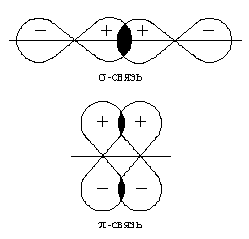
Каждая кратная связь (например, двойная или тройная) всегда содержит только одну σ -связь. Число σ -связей, которые образует центральный атом в сложных молекулах или ионах, определяет для него значение координационного числа. Термин "координационное число" используется также в других областях химии. В случае комплексных соединений он означает количество лигандов, окружающих центральный ион. В кристаллохимии координационное число показывает количество атомов кристаллической решетки, соседних с данным атомом.. Например, в молекуле NH3 и ионе NH4+ для атома азотаоно равно трем и четырем. Образование σ-связей фиксирует пространственное положение атомов относительно друг друга, поэтому число σ-связей и углы между линиями связи, которые называютсявалентными углами, определяют пространственную геометрическую конфигурацию молекул.
При оценке степени перекрывания электронных облаковследует учитывать знакиволновых функцийэлектронов. При перекрывании облаков с одинаковыми знаками волновых функций электронная плотность в пространстве между ядрами возрастает. В этом случае происходит положительное перекрывание, приводящее к взаимному притяжению ядер. Если знаки волновых функций противоположны, то плотность электронного облака уменьшается (отрицательное перекрывание), что приводит к взаимному отталкиванию ядер.
Поляризуемость рассматривают на основе представлений о том, что ковалентная связь может быть неполярной(чисто ковалентной) илиполярной.
Если двухатомная молекула состоит из атомов одного элемента, то электронное облакораспределяется в пространстве симметрично относительноядератомов. Такаяковалентная связьназываетсянеполярной. Если ковалентная связь образуется между атомами различных элементов, то общее электронное облако смещено в сторону одного из атомов. В этом случае ковалентная связь является полярной. Для оценки способности атома притягивать к себе общую электронную пару используют величину электроотрицательности.