ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2178
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
4(Е2 – Е0) = 6(Е0 – Е1),
где 4 и 6 – максимальное число электронов на d- и d-АО. Из этого равенства следует, что
(Е2 – Е0) / (Е0 – Е1) = 3/2 и (Е2 – Е1) / (Е0 – Е1>) = 5/2, или
0 / (Е0 – Е1) = 5/2, откуда (Е0 – Е1) = 2/5 0>.
Размещение каждого электрона из шести максимально возможных на d-орбитали вызывает уменьшение (выигрыш) энергии на 2/5 0.
Наоборот, размещение каждого электрона из четырех возможных на d-орбитали вызывает увеличение (затрату) энергии на 3/5 0.
Если заселить электронами d- и d-орбитали полностью, то никакого выигрыша энергии не будет (как не будет и дополнительной затраты энергии):
4 3/5 0 6 2/5 0 = 0.
Но если исходная d-АО заселена только частично и содержит от 1 до 6 электронов, и эти электроны размещаются только на d-АО, то мы получим значительный выигрыш энергии. Выигрыш энергии за счет преимущественного заселения электронами d-атомных орбиталей называют энергией стабилизации комплекса полем лигандов.
Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое. Чем сильнее поле лигандов, чем больше значение параметра расщепления 0.
Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях. Длины волн полос поглощения комплексов в кристаллическом состоянии или в растворе, обусловленные переходом электронов с d- на d-АО, связаны с параметром расщепления 0 следующим образом:
= 1 / ; 0 = Е2 – Е1 = h = h (c / ) = h c ,
где постоянная Планка h равна 6,626 1034 Дж . с; скорость света с = 3 1010 см/с. Единица измерения 0 – та же, что у волнового числа : см1, что приближенно отвечает 12 Дж/моль.
Параметр расщепления, помимо типа лиганда, зависит от степени окисления и природы комплексообразователя. В комплексных соединениях, включающих комплексообразователи одного и того же периода и в одинаковой степени окисления, с одними и теми же лигандами, параметр расщепления примерно одинаков. С ростом степени окисления комплексообразователя значение 0 увеличивается. Так, для аквакомплексов [Mn(H2O)6]2+ и [Fe(H2O)6]2+ значение параметра расщепления составляет 7800 и 10400 см1, а для [Mn(H2O)6]3+ и [Fe(H2O)6]3+ 13700 и 21000 см1 соответственно.
При увеличении заряда ядра атома-комплексообразователя 0 тоже растет. Катионы гексаамминкобальта(III) [Co(NH3)6]3+, гексаамминродия(III) [Rh(NH3)6]3+, гексаамминиридия(III) [Ir(NH3)6]3+ (Z = 27, 45 и 77) характеризуются параметрами расщепления, равными 22900, 34100 и 41000 см-1.
Зависимость 0 от природы лигандов более разнообразна. В результате исследования многочисленных комплексных соединений было установлено, что по способности увеличивать параметр расщепления металлов-комплексообразователей, находящихся в своих обычных степенях окисления, наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд, вдоль которого значение 0 монотонно растет: I Br Cl NCS NO3 F OH H2O H NH3 NO2 CN NO CO.
Таким образом, наиболее сильное электростатическое поле вокруг комплексообразователя и самое сильное расщепление d-АО вызывают лиганды NO2CN и CO.
Рассмотрим распределение электронов по d- и d-орбиталям в октаэдрическом поле лигандов. Заселение d- и d-орбиталей происходит в полном соответствии с правилом Гунда и принципом Паули. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки d-подуровня:
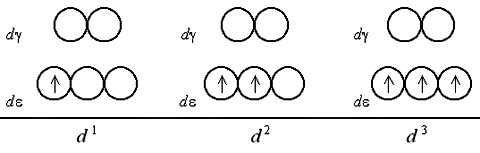
Если число электронов на d-подуровне комплексообразователя больше трех, для размещения их по расщепленным подуровням появляется две возможности. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий d- и d-орбитали; четвертый, а затем и пятый электроны заселяют квантовые ячейки d-подуровня. При сильном поле лигандов и высоком значении 0 заселение четвертым и пятым электроном d-подуровня исключено; происходит заполнение d-орбиталей.
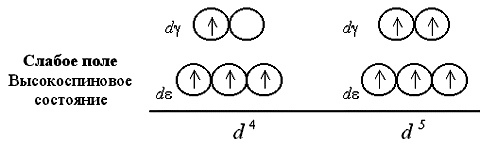
При слабом поле лигандов заселяющие квантовые ячейки 4 или 5 электронов имеют параллельные спины, поэтому получаемый комплекс оказывается сильно парамагнитен. В сильном поле лигандов образуются одна, а затем две электронные пары на d-подуровне, так что парамагнетизм комплекса оказывается гораздо слабее.
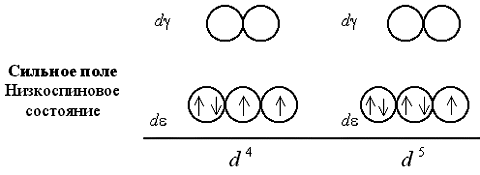
Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d-подуровне, дополняя конфигурации до электронных пар (одной в случае d6, двух – d7 и трех – d8):
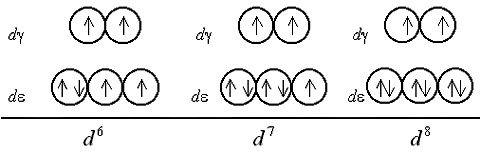
В случае сильного поля лигандов шестой электрон заселяет d-АО, приводя к диамагнетизму комплекса, после чего седьмой и восьмой электроны поступают на d-подуровень:
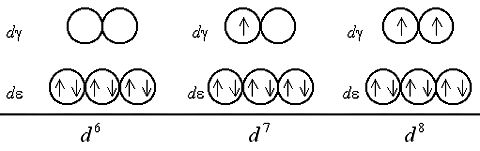
Очевидно, при восьмиэлектронной конфигурации различия в строении между комплексами с лигандами слабого и сильного поля исчезают. Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
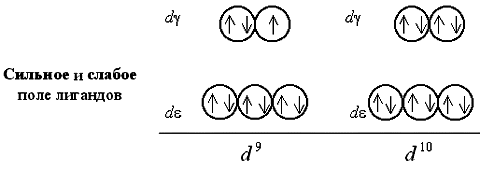
Вернемся к рассмотрению электронного строения октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3. В соответствии с расположением в спектрохимическом ряду, аммиак NH3 относится к числу лигандов сильного поля, а фторид-ион F – слабого поля. Следовательно, заселение электронами атомных орбиталей в данных комплексах будет происходит по схеме:
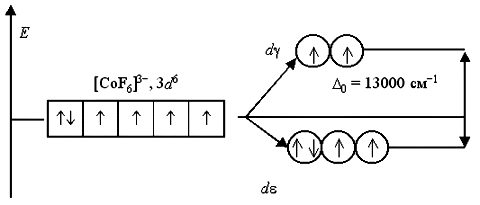
В анионе [CoF6]3 лиганды F создают слабое кристаллическое поле ( 0 = 13000 см1), и все электроны исходной 3d6-АО размещаются на d- и d-орбиталях без какого-либо спаривания. Комплексный ион является высокоспиновым и содержит четыре неспаренных электрона, поэтому он парамагнитен.
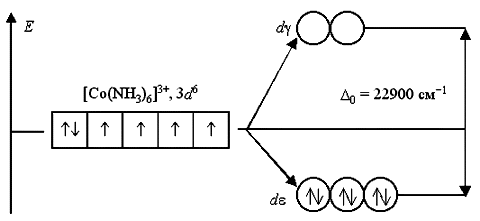
В ионе [Co(NH3)6]3+ лиганды NH3 создают сильное кристаллическое поле (0 = 22900 см1), все 3d6-электроны размещаются на более энергетически выгодной d-орбитали. Переход электронов с d- на d-орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен.
Аналогичным образом могут быть представлены схемы распределения электронов по орбиталям в октаэдрическом поле для ионов [Fe(H2O)6]2+ и [Fe(CN)6]4:
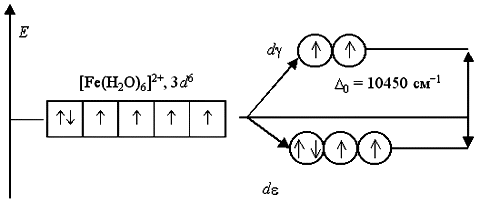
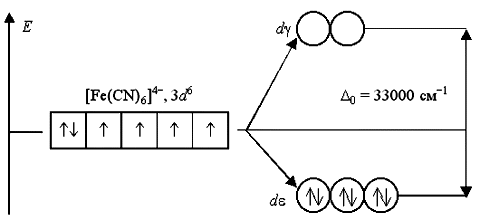
Лиганды H2O создают слабое поле; обмен электронами между d- и d-орбиталями не вызывает затруднений и поэтому число неспаренных электронов в комплексном ионе такое же, как и в условном ионе Fe+II. Получаемый аквакомплекс – высокоспиновый, парамагнитный. Наоборот, лиганды CN вызывают значительное расщепление d-АО, составляющее 33000 см1. Это значит, что существует сильная тенденция к размещению всех электронов на d-орбиталях. Выигрыш энергии, получаемый при таком заселении орбиталей, много больше энергетических затрат, обусловленных спариванием электронов.
4. Цветность комплексных соединений
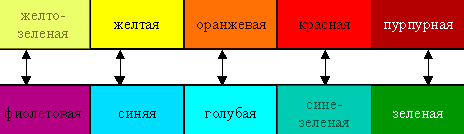
Многие комплексные соединения в кристаллическом состоянии и водном растворе отличаются яркой окраской. Так, водный раствор, содержащий катионы [Cu(NH3)4]2+, окрашен в интенсивно синий цвет, катионы [Ti(H2O)6]3+ придают раствору фиолетовую окраску, а катионы [Co(NH3)5H2O]2+ красную. Теория кристаллического поля позволяет объяснить появление той или иной окраски у комплексных соединений.
Если через раствор или кристаллический образец вещества пропускать свет видимой части спектра, то в принципе возможны три варианта физического поведения образца: отсутствие поглощения света любой длины волны (образец вещества бесцветен, хотя может иметь полосы поглощения в ультрафиолетовой области спектра); полное поглощение света во всем интервале длин волн (образец будет казаться черным); наконец, поглощение света только определенной длины волны (тогда образец будет иметь цвет, дополнительный к поглощенному узкому участку спектра). Таким образом, цвет раствора или кристаллов определяется частотой полос поглощения видимого света:
Поглощение квантов света комплексами (например, имеющими октаэдрическое строение) объясняется взаимодействием света с электронами, находящимися на d-подуровне, сопровождаемое их переходом на вакантные орбитали d-подуровня.
Например, при пропускании света через водный раствор, содержащий катионы гексаакватитана(III) [Ti(H2O)6]3+, обнаруживается полоса поглощения света в желто-зеленой области спектра (20300 см1, 500 нм). Это связано с переходом единственного электрона комплексообразователя с d-АО на d-подуровень:
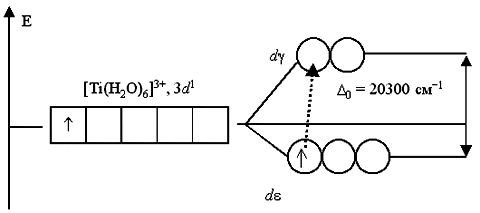
Поэтому раствор, содержащий [Ti(H2O)6]3+, приобретает фиолетовый цвет (дополнительный к поглощенному желто-зеленому).
Раствор соли ванадия [V(H2O)6]Cl3 имеет зеленый цвет. Это также обусловлено соответствующими переходами электронов при поглощении ими части энергии светового луча. В основном состоянии, при электронной конфигурации ванадия(III) 3d2, два неспаренных электрона занимают d-подуровень: