ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2185
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Разница
между значениями напряжения разложения
и поляризации называется перенапряжением.
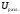 =
=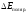 +
+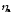 .
Газ выделяется только на аноде, поэтому
при расчете
.
Газ выделяется только на аноде, поэтому
при расчете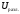 учитывается только
учитывается только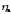 .
.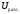 =
1,61 + 0,3 = 1,91 (В).
=
1,61 + 0,3 = 1,91 (В).
Хими́ческие исто́чники то́ка
Хими́ческие исто́чники то́ка (аббр. ХИТ) — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
По возможности или невозможности повторного использования химические источники тока делятся на:
гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
Устройство аккумулятора.
Элемент свинцово-кислотного аккумулятора состоит из положительных и отрицательных электродов, сепараторов (разделительных решеток) и электролита. Положительные электроды представляют собой свинцовую решётку, а активным веществом является оксид свинца (PbO2). Отрицательные электроды также представляют собой свинцовую решётку, а активным веществом является губчатый свинец (Pb). На практике в свинец решёток добавляют сурьмув количестве 1-2 % для повышения прочности. Сейчас в качестве легирующего компонента используются соли кальция, в обоих пластинах, или только в положительных (гибридная технология). Электроды погружены в электролит, состоящий из разбавленной серной кислоты (H2SO4). Наибольшая проводимость этого раствора при комнатной температуре достигается при его плотности 1,26 г/см3(массовая доля 35%). Однако на практике, часто в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1,29 −1,31 г/см3. (Это делается потому, что при разряде свинцово-кислотного аккумулятора плотность электролита падает уменшается концентрация серной кислоты), и температура его замерзания, т.о, становится выше, разряженный аккумулятор может не выдержать холода.)
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и оксида свинца(IV) в сернокислотной среде. Во время разряда происходит восстановление оксида свинца(IV) на катоде и окисление свинца на аноде:
Катод:
![]()
Анод:
![]()
В свинцовом аккумуляторе, таким образом, самопроизвольно протекает термодинамически разрешенная реакция:
Pb + PbO2 + H2SO4 = 2PbSO4 + 2H2O,
в результате которой совершается работа.
При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Аккумуляторы дают примерно такое же напряжение, как и гальванические элементы. Так, самый распространенный кислотный свинцовый аккумулятор дает около 2 В. Такого напряжения вполне достаточно для работы кварцевых часов, но уже лампочка для карманного фонаря гореть от одного аккумулятора не будет. Поэтому, как и гальванические элементы, аккумуляторы для повышения напряжения соединяют в батареи. Для питания диктофона, плейера или фотоаппарата достаточно двух соединенных последовательно аккумуляторов. На автомобилях соединяют последовательно уже шесть свинцовых аккумуляторов; они способны кратковременно давать очень большой ток, необходимый для запуска двигателя. Аккумуляторы работают также на космических кораблях, в электромобилях и электрокарах, их используют для аварийного освещения.
О потенциальных возможностях аккумуляторов говорит такой факт. В Берлине, опасаясь отключения электроэнергии, соорудили огромную аккумуляторную батарею. Эта батарея массой 630 тонн при мощности 17 мегаватт могла в случае необходимости в течение часа, до запуска аварийных электростанций, снабжать многомиллионный город электроэнергией.
Топливный элемент — электрохимическоеустройство, подобноегальваническому элементу, но отличающееся от него тем, что вещества дляэлектрохимическойреакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного вгальваническом элементеилиаккумуляторе.
В топливном элементе происходит преобразование энергии окислительно-восстановительной реакции в электрическую, причем, процессы окисления и восстановления пространственно разделены электролитом. Электроды и электролит в реакции не участвуют. Электрохимическое горение может идти при невысоких температурах и практически без потерь.
Основа любого ХИТ – два электрода соединенные электролитом, т.е. топливный элемент состоит из анода, катода и электролита. На аноде окисляется, т.е. отдает электроны, восстановитель (топливо CO или H2), свободные электроны с анода поступают во внешнюю цепь, а положительные ионы удерживаются на границе анод-электролит (CO+, H+). С другого конца цепи электроны подходят к катоду, на котором идет реакция восстановления (присоединение электронов кислородом с образованием O2–). Затем ионы окислителя соединяются с ионами восстановителя.
Вода является единственным продуктом реакции (в виде параилижидкости).
Твердоокси́дные (твердоо́кисные) то́пливные элеме́нты— разновидность топливных элементов, электролитом в которых является керамический материал (напр., на базедиоксида циркония), проницаемый для ионовкислорода. Эти элементы работают при очень высокой температуре (700 ºC — 1000 ºC) и применяется в основном для стационарных установок мощностью от 1 кВт и выше. Их отработанные газы могут быть использованы для приведения в действиягазовой турбины, чтобы повысить КПД (коэффициент полезного действия) установки. КПД такой гибридной установки может достигать 70 %.
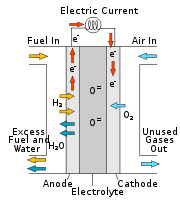 Схема
работы твердооксидного топливного
элемента.
Схема
работы твердооксидного топливного
элемента.
В этих топливных элементах ионыкислородапроходят через твёрдыйоксид, который используется в качестве электролита, и при высокой температуре реагируют сводородомна аноде. Хотя в твердооксидных топливных элементах необходима высокая рабочая температура (что требует специальных керамических материалов), зато они не нуждаются в таком дорогом катализаторе, какплатина. Это также значит, что твердооксидные топливные элементы не отравляютсямонооксидом углерода, и в них могут использоваться разные виды топлива. Твердооксидные топливные элементы могут работать наметане,пропане,бутане,биогазе. Конечно,сера, содержащаяся в топливе, должна быть удалена перед поступлением его в топливный элемент, но это легко сделать с помощью адсорбентов.
Прямой метаноловый топливный элемент —это разновидность топливного элемента с протонообменной мембраной, в котором топливо,метанол, предварительно не разлагается с выделением водорода, а напрямую используется втопливном элементе.
Поскольку метанол поступает в топливный элементнапрямую,каталитический риформинг(разложение метанола) не нужен; хранитьметанолгораздо проще, чемводород, поскольку нет необходимости поддерживать высокое давление, так как метанол при атмосферном давлении является жидкостью. Энергетическая ёмкость (количество энергии в данном объеме) у метанола выше, чем в таком же объеме сильно сжатого водорода. Например, современные баллоны высокого давления, позволяющие хранить водород при 800 атм., содержат 5-7 массовых % водорода по отношению к общей массе баллона. При подсчете такого "водородного" эквивалента для метанола получается 13%. Такая энергоёмкость является максимальной из всех известных систем хранения топлива для топливных элементов.
Водородная энергетика — направление выработки и потребления энергиичеловечеством, основанное на использованииводородав качестве средства для аккумулирования, транспортировки и потребления энергии людьми, транспортной инфраструктурой и различными производственными направлениями. Водород выбран как наиболее распространенный элемент на поверхности земли и в космосе,теплота сгоранияводорода высока, а продуктом сгорания вкислородеявляетсявода(которая вновь вводится в оборот водородной энергетики К концу2008 годаво всём мире функционировало 2000 водородных автомобильных заправочных станций. Из общего количествазаправочных станций, построенных2004—2005 году, всего 8 % работают с жидкимводородом, остальные с газообразным.