ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2217
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Следствия.
1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (T = 273K, P = 1 атм ( 101,3 кПа)) 1 моль любого газа занимает объем 22,4 л.
3) Закон Авогадро позволяет определить М газа, нужно только знать его относительную плотность по другому газу. Относительная плотность показывает, во сколько раз 1 моль одного газа тяжелее (или легче) 1 моля другого газа.
DA(B) = Mr(B) / Mr(A) = M(B) / M(A)
Пример 1. Какой объем водорода при н.у. выделится при растворении 4,8 г магния в избытке соляной кислоты?
Решение.
Mg + 2HCl = MgCl2 + H2.
При растворении 24 г (1 моль) магния в HCl выделилось 22,4 л (1 моль) водорода; при растворении 4,8 г магния –– Х л водорода.
X = (4,8 • 22,4) / 24 = 4,48 л водорода
Пример 1.
3,17 г хлора занимают объем, равный 1 л (при н.у.). Вычислить по этим данным молярную массу хлора.
Решение.
Находим массу 22,4 л хлора
1 л––3,17 г хлора
22,4 л–– Х г хлора
X = 3,17 • 22,4 = 71 г
Следовательно, молярная масса хлора = 71г/моль.
Пример2. Плотность некоторого газообразного вещества по водороду равна 17. Чему равна его плотность по воздуху (Мвозд.=29).
Решение. D(H2)= Mв-ва / M(H2)
Мв-ва= 2D(H2) = 34г/моль.
Dвозд
=
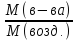 =
=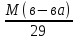 =
34 / 29 = 1,17
=
34 / 29 = 1,17
Пример3. Определить плотность по воздуху смеси азота, аргона и углекислого газа, если массовые доли компонентов составляют 15, 50 и 35% соответственно.
Решение. Dсмеси(по воздуху) = Mсмеси / Mвозд. = Мсмеси / 29
Mсмеси = (15 28 + 50 40 + 35 44) / 100 = (420 + 2000 + 1540) / 100 = 39,6г/моль.
Dсмеси(по воздуху) = Mсмеси / 29 = 39,6 / 29 = 1,37
Пример4.М газа можно определить, зная плотность г/л и умножить на 22,4 л.
Если плотность Н2 при н.у. (Н2) = 0,089 г/л, то его молярная масса М(Н2) = V. M = 0,089 г/л 22,4 л/моль = 2 г/моль
Газовые законы строго выполняются лишь для идеальных газов, в котором молекулы не имеют объема (т.е. представляют собой материальные точки) и сталкиваются между собой упруго. Так как в природе идеального газа нет, газовые законы имеют приближенный характер.
P1V1 / T1 = P2V2 / T2
И, наоборот, из объединенного газового закона
при P = const (P1 = P2) можно получить
V1 / T1 = V2 / T2 (закон Гей-Люссака);
при Т= const (T1 = T2):
P1V1 = P2V2 (закон Бойля-Мариотта);
при V = const
P1 / T1 = P2 / T2 (закон Шарля).
Объединенный газовый закон - объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение,называемое уравнением Менделеева –Клайперона, которое можно записать так:
РV
= nRT
=
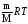 ,
,
если условия отличаются от нормальных. В СИ единицы Р – Па, V – м3, n – число моль, Т – К, m – кг, М – кг/моль, то R = 8,314 Дж/(моль К) (или 0,082 л атм/(моль • К)).
Пример. Какой объем займет при температуре 17°C и давлении 250 кПа оксид углерода (II) массой 84 г?
Решение. Количество моль CO равно: n(CO) = m(CO) / M(CO) = 84 / 28 = 3 моль Объем CO при н.у. составляет 3 22,4 л = 67,2 л
Для данной массы конкретного газа отношение m / M постоянно, поэтому из уравнения Менделеева – Клайперона получается объединенный газовый закон. Из объединенного газового закона Бойля-Мариотта и Гей-Люссака:
(P · V) / T = (P0 V0) / T0
Следует V(CO) = (P0T V0) / (P · T0) = (101,3 · (273 + 17) · 67,2) / (250 · 273) = 28,93 л
Средняя молекулярная масса смеси газов равна общей массе смеси, деленной на общее число молей:
Mср = (m1 +.... + mn) / (n1 +.... + nn) = (M1 V1 + Mn · Vn) / (n1 +.... + nn)
Закон эквивалентов
(Рихтер 1800г.):
Все вещества реагируют в эквивалентных соотношениях или массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ:
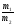 =
=
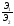
Эквивалент - реальная или условная частица, которая в данной кислотно-основной реакции, в реакции ионного обмена равноценна одному молю атомарного (одному молю ионов) водорода или в окислительно-восстановительной реакции – одному молю электронов.
Фактор
эквивалентности fэкв(Х)
– число, обозначающее долю реальной
или условной частицы, которая в реакции
ионного обмена равноценна одному молю
атоматомарного (одному молю ионов)
водорода или в окислительно-восстановительной
реакции – одному молю электронов.
Фактор эквивалентности (fэкв =
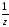 )
может равняться единице или быть меньше
ее.
)
может равняться единице или быть меньше
ее.
Молярная
масса эквивалента вещества М[ (Х)]
равна произведению фактора эквивалентности
fэкв(Х) на молярную массу вещества Х.
Молярную массу эквивалента различных
веществ можно рассчитать по формулам:
(Х)]
равна произведению фактора эквивалентности
fэкв(Х) на молярную массу вещества Х.
Молярную массу эквивалента различных
веществ можно рассчитать по формулам:
М( оксида)
=
оксида)
=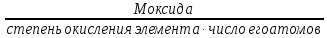 ;
;
М(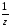 кислоты)
=
кислоты)
=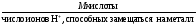 ;
;
М(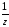 основания)
=
основания)
=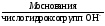 ;
;
М(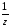 соли)
=
соли)
=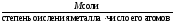 .
.
Например:
М(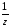 H2SO4)
=
H2SO4)
=
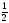
М(H
М(H SO
SO )
=
)
=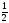
98 = 49 г/моль.
98 = 49 г/моль.
М(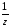 Са(ОН)2)
=
Са(ОН)2)
=
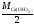 ;
;
М(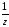 Al
Al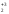 (SO4)3)
=
(SO4)3)
=
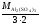 =
=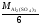 .
.
Пример 1. Определить эквивалент Mg, зная, что 3 весовых части магния соединяются с 2 весовыми частями О.
Mэ(Mg)
3 : 2 = ЭMg : 8
ЭMg
=
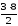 = 12
= 12
Пример 2. CaCl2 содержит 36% Са и 64%Cl. Определить эквивалент кальция, зная, что эквивалент хлора равен 35,5
36 : 64 = ЭСа : 35,5
ЭСа
=
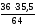 = 20
= 20
Основные классы неорганических
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
|
Неорганические вещества |
|
|
Простые |
Металлы |
|
Неметаллы |
|
|
Сложные |
Оксиды |
|
Основания |
|
|
Кислоты |
|
|
Соли |
|
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
Аллотропия - способность некоторых химических элементов образовывать несколько простых веществ, различающихся по строению и свойствам.
С - алмаз, графит, карбин, фуллурены.
O - кислород, озон.
S - ромбическая, моноклинная, пластическая.
P - белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:1) различным числом атомов в молекуле, например кислород O2 и озон O3; 2) образованием различных кристаллических форм, например алмаз и графит.
ОКСИДЫ
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
Классификация
|
|
|
|
Несолеобразующие |
CO, N2O, NO |
|
Солеобразующие |
Основные -это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2 Na2O; MgO; CuO |
|
|
Амфотерные -это оксиды металлов со степенью окисления +3, +4 (Al2O3; Cr2O3; SnO2=) и +2: ZnO, BeO, SnO, PbO. В качестве гидратов им соответствуют амфотерные гидроксиды. |
|
|
Кислотные -это оксиды неметаллов со всеми степенями окисления и металлов со степенью окисления от +5 и выше: SO2; SO3; P2O5; Mn2O7; CrO3. |
|
|
Основным оксидам соответствуют основания, кислотным оксидам – кислоты, амфотерным – амфотерные гидроксиды. |
Получение оксидов
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 = 2MgO
4P + 5O2 = 2P2O5
S + O2 = SO2
2CO + O2= = 2CO2
2CuS + 3O2 = 2CuO + 2SO2
CH4 + 2O2 = CO2 + 2H2O
4NH3 + 5O2═ 4NO + 6H2O