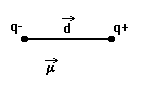ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2223
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов

В результате образования полярной ковалентной связи более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд. Эти заряды принято называть эффективными зарядами атомов в молекуле. Они могут иметь дробную величину. Например, в молекуле HСlэффективный заряд равен 0,17e (где е – заряд электрона.Заряд электрона равен 1,602.10-19 Кл.):
Hq+Clq– (q=0,17 e)
|
|
![]()
В системе СИдипольный момент измеряется в Кл∙м, но обычно для полярных молекул в качестве единицы измерения используетсядебай(единица названа в честьП. Дебая):
1 D = 3,33∙10–30 Кл∙м
Следует различать полярность связей и полярность молекул. Связи в молекуле могут быть полярными, а сами молекулы неполярными в случае высокой симметрии молекулы. Дипольный момент служит количественной мерой полярности молекулы. Для многоатомных молекул дипольный момент представляет собой векторную сумму дипольных моментовхимических связей. Поэтому, если молекуласимметрична, то она может быть неполярной, даже если каждая из ее связей обладает значительным дипольным моментом. Например, в плоской молекуле BF3 или в линейной молекуле BeCl2 сумма дипольных моментов связей равна нулю:
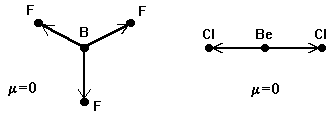
Аналогично, нулевой дипольный момент имеют тетраэдрическиемолекулыCH4 и CBr4, СО2 (sp-гибридизация) и SO3 (sp2-гибридизация). Однако, нарушение симметрии, например в молекуле BF2Cl, обусловливает дипольный момент, отличный от нуля.
Важными характеристиками химической связи являются также ее длина и кратность. Длина связи определяется расстоянием между ядрами связанных атомов в молекуле. Как правило, длина химической связи меньше, чем сумма радиусов атомов, за счет перекрывания электронных облаков. Кратность связи определяется количеством электронных пар, связывающих два атома, например:
этан H3C–CH3 одинарная связь (-связь)
этилен H2C=CH2 двойная связь (одна -связь и одна -связь)
ацетилен HCCH тройная связь (одна -связь и две -связи).
С увеличением кратности возрастает энергия связи, однако это возрастание не пропорционально кратности, т.к.-связи менее прочны, чем-связь.
Способы образования ковалентной связи
Существуют два главных способа (механизма) образования ковалентной связи.
1) Спинвалентный (обменный) механизм: электронная пара, образующая связь, образуется за счет неспаренных электронов, имеющихся в невозбужденныхатомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углеродаимеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результатевозбуждения атома. При этом один из s-электронов переходит на p-подуровень:
![]()
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентностьатома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомовазота,кислорода,фтораколичество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободныхорбиталей, а перемещение электронов на третийквантовый уровеньтребует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободные орбитали возможны только в пределах одного энергетического уровня.
Элементы 3-го периода – фосфор,сера,хлор– могут проявлять валентность, равную номеругруппы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s22s22p63s13p33d1 (валентность 5)
S* 1s22s22p63s13p33d2 (валентность 6)
Cl* 1s22s22p63s13p33d3 (валентность 7)
В приведенных выше электронных формулахвозбужденных атомов подчеркнутыподуровни, содержащие только неспаренные электроны. На примере атома хлора легко показать, что валентность может быть переменной:
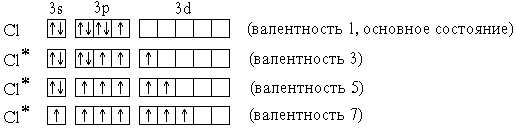
В отличие от хлора, валентность атомаFпостоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуют орбитали d-подуровня и другие вакантные орбитали.
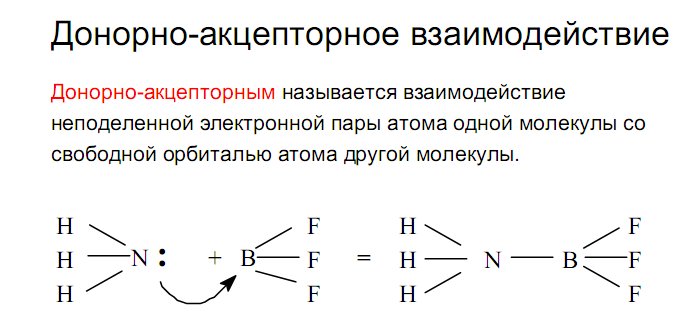
2) Донорно-акцепторный механизм: ковалентныесвязи образуются за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Например, образованиеиона аммонияиз молекулыаммиакаи иона водорода можно отобразить схемой: (изображение электронов крестиками и точками на приведенной ниже схеме весьма условно, т.к. в действительности электроны неразличимы):
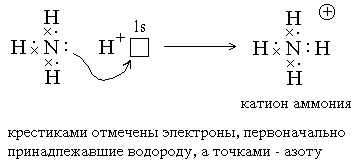
Атом, предоставляющий свою электронную пару для образования ковалентной связи, называется донором, а атом, предоставляющий пустую орбиталь, – акцептором. Ковалентная связь, образованная таким способом, называетсядонорно-акцепторной связью. В катионе аммония эта связь по своим свойствам абсолютно идентична трем другим ковалентным связям, образованнымобменным способом.

Гибридизация атомных орбиталей
Для объяснения отличия валентных угловв молекулах H2O (104,5) и NH3 (107,3) от 90 следует принять во внимание, что устойчивому состоянию молекулы отвечает ее геометрическая структура с наименьшей потенциальной энергией. Поэтому при образовании молекулы форма и взаимное расположениеатомных электронных облаковизменяется по сравнению с их формой и расположением в свободных атомах. В результате достигается более полное перекрываниеорбиталейпри образованиихимической связи. Такая деформация электронных облаков требует затраты энергии, но более полное перекрывание приводит к образованию более прочной связи, и в целом получается выигрыш в энергии. Этим и объясняетсявозникновение гибридных орбиталей.
Форма гибридной орбитали может быть определена математически путем сложения волновых функцийисходных орбиталей:
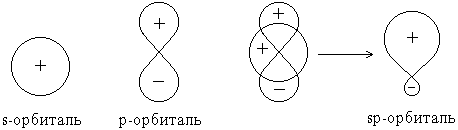
В результате сложения волновых функций s- и p-орбиталей с учетом их знаков оказывается, что плотность электронного облака(величина 2) по одну сторону от ядра повышена, а по другую – понижена.
В целом процесс гибридизации включает следующие этапы: возбуждение атома,гибридизация орбиталейвозбужденного атома, образование связей с другими атомами. Затраты энергии на первые два этапа компенсируются выигрышем энергии при образовании более прочных связей с гибридными орбиталями. Тип гибридизации определяется типом и количеством участвующих в ней орбиталей.
Ниже рассмотрены примеры различных видов гибридизации s- и p-орбиталей.

Гибридизация одной s- и одной p-орбитали (sp-гибридизация) происходит, например, при образовании гидрида бериллия, галогенидовбериллия,цинка,кадмияиртути. Атомы этих элементов в нормальном состоянии имеют во внешнем слое два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в p-состояние – появляется два неспаренных электрона, один из которых s-, а другой p-электрон. При образованиихимической связиэти две различные орбитали преобразуются в две одинаковые гибридные орбитали.Общее количество орбиталей при гибридизации не изменяется. Две sp- гибридные орбитали направлены под углом 180º друг к другу и образуют две связи (рисунок 2):
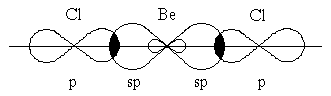
Рисунок 2 – Перекрывание sp-орбиталей бериллия и p-орбиталей хлора в молекуле BeCl2
Экспериментальное определение структуры молекул BeГ2, ZnГ2, CdГ2, HgГ2 (Г–галоген) показало, что эти молекулы являютсялинейными, и обе связи металла с атомами галогена имеют одинаковую длину.
Гибридизация одной s- и двух p-орбиталей (sp2-гибридизация) имеет место, например, при образовании соединений бора. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя p-электронами. Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120 друг к другу (рисунок 3). Действительно, как показывают экспериментальные исследования, молекулы таких соединений бора, как BГ3 (Г-галоген), B(CH3)3 – триметилбор, B(OH)3 – борная кислота, имеют плоское строение. При этом три связи бора в указанных молекулах имеют одинаковую длину и расположены под углом 120.
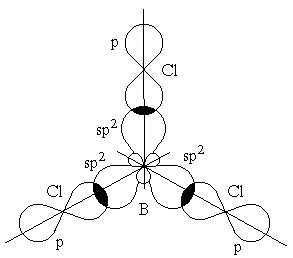
Рисунок 3– Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3
Гибридизация одной s- и трех p-орбиталей (sp3-гибридизация) характерна, например, для углеродаи его аналогов –кремнияигермания. В этом случае четыре гибридные sp3-орбитали расположены под углом 10928 друг к другу; они направлены к вершинам тетраэдра(в молекулах CH4, CCl4, SiH4, GeBr4 и др.). Валентные углыв молекулах H2O (104,5º) и NH3 (107,3º) не точно соответствуют взаимному расположению “чистых” p-орбиталей (90º). Это обусловлено некоторым вкладом s-электронов в образование химической связи. Такой вклад есть не что иное, как гибридизация. Валентные электроны в этих молекулах занимают четыре орбитали, которые близки к sp3-гибридным. Незначительное отличие валентных углов от тетраэдрических 109º28' объясняется, согласно теории Гиллеспи,тем, что неподеленные гибридные орбитали занимают в пространстве больший объем.