ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2203
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Желудочный сок 1,4 Раствор буры 9,2
Лимонный сок 2,1 Известковая вода 10,5
Апельсиновый сок 2,8 Кровь 7,4
Томатный сок 4,1 1М раствор NaOH 14,0
Молоко 6,9 Насыщенный раствор ~15,0
NaOH
Нижняя и верхняя границы измерения рН водных растворов отвечают значениям рН = 1 и рН = 13 (рОН = 1), поскольку при рН < 1 и рН > 13 растворы перестают быть разбавленными. Наоборот, в предельно разбавленных растворах (при их бесконечно малой концентрации) значение рН стремится к семи и определяется диссоциацией самой воды.
Ионное равновесие, как и любое другое, смещается при изменении концентрации одного из ионов. Например, если в раствор уксусной кислоты, диссоциирующей по уравнению
CH3COOH
![]() H+
+ CH3COO–
H+
+ CH3COO–
ввести какую-либо соль этой кислоты и тем самым увеличить концентрацию ионов CH3COO–, то в соответствии с принципом Ле-Шателье равновесие смещается влево. Отсюда следует, что введение в раствор слабого электролита одноименных ионов (т.е. ионов, одинаковых с одним из ионов электролита) уменьшает степень диссоциации этого электролита
Пример 1.Вычислить концентрацию ионов Н+, ОН-и рН раствора 0,1 н.H2SO4.
Решение.H2SO4– сильная кислота:H2SO4= 2Н++SO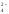 .
.
Для сильных электролитов = 1. В реакции диссоциации образуются 2 иона Н+. Молярная концентрацияH2SO4в два раза меньше ее нормальной концентрации и равна 0,05 моль/л.
Концентрация ионов водорода равна:
CH =nС0= 12С0= 2С0= 20,05 = 0,1 моль/л;
=nС0= 12С0= 2С0= 20,05 = 0,1 моль/л;
COH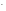 =
=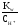 =
=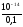 = 110-13моль/л;
= 110-13моль/л;
рН = -lgCH = -lg(0,1) = 1.
= -lg(0,1) = 1.
Пример 2.Вычислить концентрацию ионов Н+, ОН-и рН 0,1 М раствораHNO2.
Решение. Запишем уравнение диссоциации кислоты:
HNO2![]() Н++NO
Н++NO .
.
Поскольку кислота слабая,
степень диссоциации находим по формуле:
=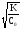 =
=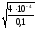 =
=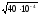 = 6,3210-2, где
КHNO
= 6,3210-2, где
КHNO = 410-4.
= 410-4.
При диссоциации кислоты образуются ионы Н+, концентрацию которых найдем по формуле:
CH =С0= 6,3210-20,1 = 6,3210-3моль/л.
=С0= 6,3210-20,1 = 6,3210-3моль/л.
Концентрацию ионов ОН-определим из выражения ионного произведения воды:
COH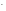 =
=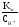 =
=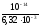 = 1,5810-10моль/л.
= 1,5810-10моль/л.
рН = -lgCH = -lg(6,3210-3) = 3 –lg(6,32) = 3 –
0,80 = 2,20.
= -lg(6,3210-3) = 3 –lg(6,32) = 3 –
0,80 = 2,20.
Пример 3.Определить степень диссоциации угольной кислоты в 0,01 М растворе, учитывая только первую ступень диссоциации, если рН этого раствора равен 4,17.
Решение. Уравнение диссоциации кислоты:
Н2СО3![]() Н++ НСО
Н++ НСО (Iступень).
(Iступень).
Найдем концентрацию ионов
Н+. Для этого найдем антилогарифм
числа -4,17, т.к. рН = -lgCH :
:
CH = 10
= 10 = 10-4,17= 6,7610-5моль/л.
= 10-4,17= 6,7610-5моль/л.
Степень диссоциации найдем следующим образом:
CH =С0,=
=С0,=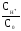 =
=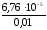 = 6,7610-3.
= 6,7610-3.
В растворах слабых электролитов многоосновных кислот и многокислотных оснований диссоциация преимущественно осуществляется по первой ступени и количество ионов Н+или ОН-определяется этим процессом. Количеством ионов, образующихся при последующих ступенях диссоциации пренебрегают, так как оно незначительно.
Пример 4.Вычислить рН 0,1 М НСООН, к 1 л которого добавлено 0,1 моль НСООNa.
Запишем уравнение уравнения диссоциации слабого и сильного электролитов:
НСООН
![]() Н++ НСОО-; Кдис.=
Н++ НСОО-; Кдис.=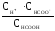 = 1,810-4.
= 1,810-4.
НСООNa→Na++ НСОО-;= 1.
Вклад в общую
концентрацию формиат-ионов НСОО-в растворе процесса диссоциации кислоты
очень мал (слабый электролит), поэтому
СНСОО определяется процессом диссоциации
соли, которая относится к сильным
электролитам и диссоциирует практически
нацело:
определяется процессом диссоциации
соли, которая относится к сильным
электролитам и диссоциирует практически
нацело:
СНСОО = СНСООNa= 0,1 моль/л.
= СНСООNa= 0,1 моль/л.
Обозначим за х концентрацию ионов водорода в растворе:
CH = х, СНСОО
= х, СНСОО = 0,1 моль/л.
= 0,1 моль/л.
Равновесная концентрация кислоты за счет диссоциации изменится очень незначительно, поэтому принимаем её равной начальной: CНСООН= 0,1 моль/л.
Тогда
Кдис.=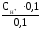 = 1,810-4;
= 1,810-4;
CH = 1,810-4.
= 1,810-4.
Водородный показатель:
рН = -lgCH = -lg(1,810-4) = 4 –lg1,8 = 3,15.
= -lg(1,810-4) = 4 –lg1,8 = 3,15.
Произведение растворимости
Растворение твердых электролитов прекращается, когда образуется насыщенный раствор, в котором устанавливается гетерогенное равновесие между твердой фазой и перешедшими в раствор ионами. Например:
[CaSO4] ![]() {Ca2+}
+ {SO42–}
(1)
{Ca2+}
+ {SO42–}
(1)
В выражение константы этого гетерогенного равновесия не входит концентрация твердой фазы
K = C(Ca2+)∙(SO42–)
В насыщенном растворе твердого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Она называется произведением растворимости.
ПР(CaSO4) = C(Ca2+)∙(SO42–)
Если молекула электролита содержит несколько одинаковых ионов, то концентрации этих ионов, согласно закону действующих масс, должны быть возведены в соответствующие степени. Например:
[PbI2]![]() {Pb2+}
+ 2{I–}
{Pb2+}
+ 2{I–}
ПР(PbI2) = C(Pb2+)∙C(I–)2
Зная произведения растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях. Например, пусть диссоциация соли АВ происходит на два иона:
АВ![]() А+
+ В–
А+
+ В–
Обозначив
растворимость через s
(моль/л), получим C(A+)=
C(B‑)
=s,
ПР=s2.
На практике чаще возникает обратная
задача определения растворимости. Для
соли, диссоциирующей на два иона, ![]() .
Значения ПР можно найти вхимических
справочниках,
справочные величины табулируются обычно
при 298К.
Например, ПР(AgCl)=1,56∙10–10,
ПР(AgBr)=4,4∙10–13,
ПР(BaSO4)=1,1∙10–10,
ПР(HgS)=4∙10–53.
Если соль имеет общую формулу AB2,
то она диссоциирует по уравнению:
.
Значения ПР можно найти вхимических
справочниках,
справочные величины табулируются обычно
при 298К.
Например, ПР(AgCl)=1,56∙10–10,
ПР(AgBr)=4,4∙10–13,
ПР(BaSO4)=1,1∙10–10,
ПР(HgS)=4∙10–53.
Если соль имеет общую формулу AB2,
то она диссоциирует по уравнению:
AB2![]() A2+
+ 2 B–
A2+
+ 2 B–
В
этом
случае
C(A2+)=s,
C(B–)=2s,
ПР=
s
(2s)2=4s3, ![]() .
.
Если фактическое произведение концентраций (ПС) ионов в некотором растворе превышает значение произведения растворимости, т.е. ПС>ПР, то раствор является пересыщенным, и из него выпадает осадок. Условие растворения осадка (ненасыщенности раствора): ПС<ПР. Оба процесса идут с одинаковой скоростью, и система приходит в состояние равновесия при ПС=ПР (насыщенный раствор).
ПРИМЕР 1. Вычислить массу хромата серебра, находящуюся в его насыщенном растворе объемом 1 л. ПР(Ag2CrO4) = 4,05·10-12.
РЕШЕНИЕ. Равновесие растворимости в насыщенном растворе Ag2CrO4:
[Ag2CrO4]
+ aq
![]() 2{Ag+}aq
+ { CrO42-}aq
.
2{Ag+}aq
+ { CrO42-}aq
.
ПР = С2Ag+·СCrO42- = 4,05·10-12.
Пусть Со (Со = s) – концентрация насыщенного раствора Ag2CrO4. Соль Ag2CrO4 – сильный электролит, α ≈ 1.
СAg+ = Со·α·n = 2Со; СCrO42-= Со, так как α = 1, n = 1.
Получаем ПР = (2Со)2·Со = 4Со3, откуда Со = 3√4,05·10-12/4 = 1,004·10-4 моль/л.
Поскольку Со = m/М·V,
m(Ag2CrO4) = Со·М ·V = 1,004 ·10-4· 332 · 1 = 3,3·10-2г.
Полученные данные позволяют вычислить объем воды, необходимый для растворения определенной навески соли.
ПРИМЕР 2. Вычислить объем воды, необходимый для растворения 50 мг хромата серебра.
РЕШЕНИЕ. Воспользуемся результатами, полученными в примере 1, согласно которым в 1 л насыщенного раствора Ag2CrO4 содержится 3,3·10-2г Ag2CrO4. При такой низкой концентрации соли объем насыщенного раствора практически равен объему воды. Таким образом,
в 1 л воды растворяется 3,3·10-2г Ag2CrO4,
в х л воды растворяется 0,05г Ag2CrO4.
х = 0,05/0,033 = 1,52л.
Если в равновесную систему (1), содержащую в растворе ионы My+, Ax- и твердую фазу МхАy, ввести электролит, имеющий в составе либо My+, либо Ax-, то это, в соответствии с принципом Ле Шателье, приведет к образованию дополнительного количества осадка. Следовательно, присутствие одноименного иона понижает растворимость малорастворимого электролита. Величина ПР, как всякая константа равновесия, зависит только от природы электролита и температуры и не изменяется с изменением концентраций ионов в насыщенном растворе.
ПРИМЕР 3. Определить растворимость хлорида серебра в чистой воде и в 0,1М растворе хлорида натрия. ПР(AgCl) = 1,56·10-10.
РЕШЕНИЕ. В насыщенном растворе AgCl устанавливается равновесие:
[AgCl]
+ aq
![]() {Ag+}aq
+ { Cl-}aq
; α
= 1 (3).
{Ag+}aq
+ { Cl-}aq
; α
= 1 (3).
ПР = СAg+·СCl- = 1,56·10-10.
При отсутствии других электролитов в системе концентрации ионов Ag+ и Cl- одинаковы: СAg+ = СCl- = Со. ПР = СAg+·СCl- = Со2.