ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2163
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
![]()
 х
х
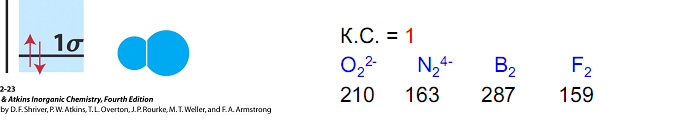
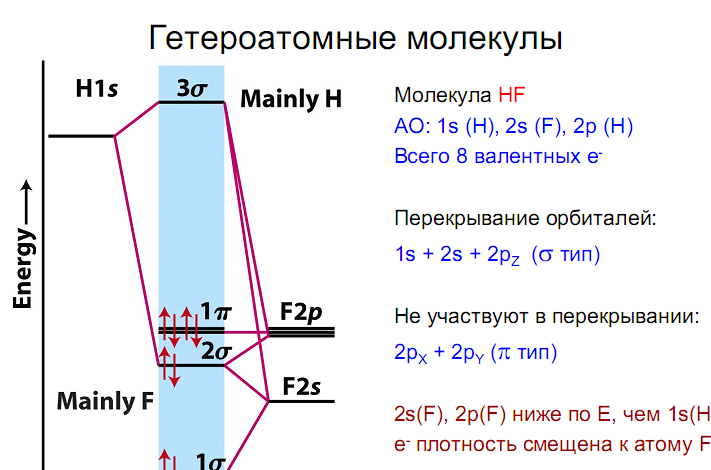
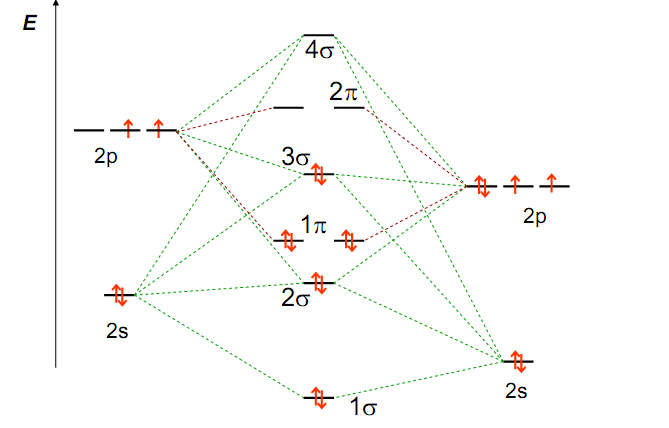
В случае молекул, имеющих три и более атома, энергетические диаграммы все более усложняются. Поэтому описание многоатомных молекул с позиций метода МО становится менее наглядным, а следовательно, и менее удобным.
Ионная связь
Предельным случаем ковалентной полярной связи является ионная связь. Она образуется атомами,электроотрицательностикоторых значительно различаются. При образовании ионной связи происходит почти полный переход связующей электронной пары к одному из атомов, и образуются положительный и отрицательныйионы, удерживаемые вблизи друг другаэлектростатическими силами.
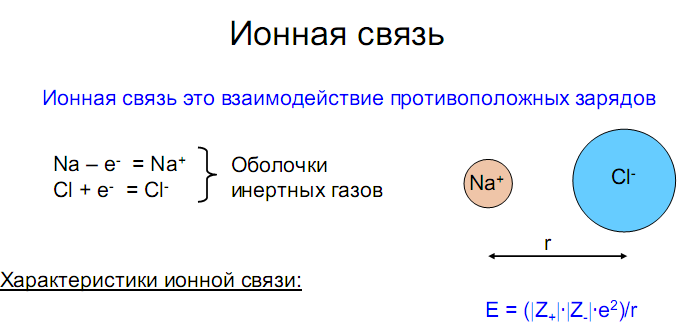

Поскольку электростатическое притяжение к данному иону действует на любые ионы противоположного знака независимо от направления, ионная связь, в отличие от ковалентной, характеризуется ненаправленностью и ненасыщаемостью. Молекулы с наиболее выраженной ионной связью образуются из атомов типичных металлов и типичных неметаллов (NaCl, CsF и т.п.), т.е. когда различие в электроотрицательности атомов велико.
Водородная связь
Некоторые соединения водородас сильноэлектроотрицательныминеметаллами имеют аномально высокиетемпературы кипения:
|
|
tкип, С |
|
|
tкип, С |
|
H2O |
+100 |
|
HF |
+19 |
|
H2S |
–60 |
|
HCl |
–84 |
|
H2Se |
–41 |
|
HBr |
–67 |
|
H2Te |
–2 |
|
HI |
–35 |
Температуры кипения водыифтористого водорода, выпадающие из общей закономерности в приведенных рядах соединений, свидетельствуют о наличии специфического взаимодействия между молекулами. Связи в H2O и HF сильно полярны. Вследствие кулоновского взаимодействия.Кроме кулоновского (электростатического) взаимодействия, при более строгом рассмотрении необходимо учитывать также орбитальное взаимодействие молекул при образовании водородной связи. происходит притяжение противоположно заряженных концов молекул, и возникает межмолекулярная водородная связь:
![]()
Энергия такой связи составляет 20–30 кДж/моль, что на порядок меньше энергии ковалентной связи. Тем не менее, водородная связь обусловливает существование в газовой фазедимерных молекулводы и фтористого водорода.


Квантовомеханические теории строения комплексных соединений
Теоретические представления о природе комплексообразования возникли из попыток дать объяснение химическому взаимодействию устойчивых молекул с ионами и атомами различных элементов – например, молекулы иода с иодид-ионом, молекулы монооксида углерода с атомами железа, кобальта, никеля и т.п.
Одновременно шел поиск причин заметной неспецифичности таких взаимодействий, в результате чего оказываются прочно связаны между собой и ионы, и атомы, и молекулы. Например, в хлориде дихлороакватриамминкобальта(III) [Co(NH3)3(H2O)Cl2]Cl с комплексообразователем связаны и хлорид-ионы, и нейтральные молекулы аммиака и воды.
Химические связи в комплексных (координационных) соединениях отличаются большим разнообразием, что обусловлено всевозможными сочетаниями ковалентных связей разной полярности, кратности и степени делокализации электронных пар.
В свое время было предложено много различных теорий связи в координационных соединениях,∙ мы рассматрим основные понятия только теории валентных связей (метода валентных связей) и теории кристаллического поля.
1. Теория валентных связей
Теория валентных связей была первой из квантовомеханических теорий, использованной для приближенного объяснения характера химических связей в комплексных соединениях. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (атомные орбитали) своих энергетических уровней.
Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя.
При этом часто происходит объединение неспаренных электронов комплексообразователя в пары, что позволяет высвободить некоторое число квантовых ячеек – атомных орбиталей, которые затем участвуют в гибридизации и образовании химических связей.
Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит перекрывание соответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, в свою очередь, взаимодействуют с вакантными атомными орбиталями лиганда, упрочняя связь по дативному механизму. Таким образом, химическая связь в комплексных соединениях является обычной ковалентной связью, достаточной прочной и энергетически выгодной.
Электронные пары, находящиеся на гибридных орбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации.
Рассмотрим образование некоторых комплексов с позиций теории валентных связей. Прежде всего отметим, что валентные орбитали атомов комплексообразователей близки по энергии:
E(n1)d Ens Enp End
|
Тип гибридизации |
КЧ |
Геометрия комплекса |
Примеры |
|
sp |
2 |
линейная |
[Ag(CN)2] [Cu(NH3)2]+ |
|
sp2 |
3 |
треугольная |
[HgI3] |
|
sp3 |
4 |
тетраэдр |
Be(OH)4]2 [MnCl4]2 [Zn(NH3)4]2+ |
|
dsp2 |
4 |
квадрат |
[Ni(CN)4]2 [PtCl4]2 [Pt(NH3)2Cl2]0 |
|
sp3d(z2) |
5 |
тригональная бипирамида |
[Fe(CO)5] |
|
sp3d(x2y2) |
5 |
квадратная пирамида |
[MnCl5]3 [Ni(CN)5]3 |
|
sp3d2, d2sp3 |
6 |
октаэдр |
[Al(H2O)6]3+ [SnCl6]2 [Co(NH3)6]3+ [Fe(CN)6]3 |
|
sp3d3 |
7 |
пентагональная бипирамида |
[V(CN)7]4 [ZrF7]3 |
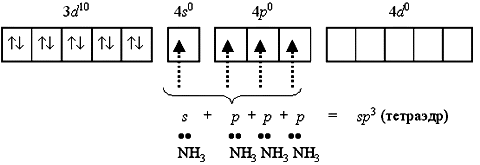
Например, катион [Zn(NH3)4]2+ включает комплексообразователь цинк(II). Электронная оболочка этого условного иона имеет формулу [Ar] 3d10 4s0 4p0 и может быть условно изображена так:
Вакантные 4s- и 4p-орбитали атома цинка(II) образуют четыре sp3-гибридные орбитали, ориентированные к вершинам тетраэдра. Каждая молекула аммиака имеет неподеленную пару электронов у атома азота. Орбитали атомов азота, содержащие неподеленные пары электронов, перекрываются с sp3-гибридными орбиталями цинка(II), образуя тетраэдрический комплексный катион тетраамминцинка(II) [Zn(NH3)4]2+: