ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2212
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2═ CuO + H2O
(CuOH)2CO3═ 2CuO + CO2 + H2O
2Pb(NO3)2═ 2PbO + 4NO2 + O2
2HMnO4═ Mn2O7 + H=O
Химические свойства оксидов
|
Основные оксиды |
Кислотные оксиды |
|
1. Взаимодействие с водой |
|
|
Образуется основание: Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2 |
Образуется кислота: SO3 + H2O = H2SO4 P2O5 + 3H2O = 2H3PO4 |
|
2. Взаимодействие с кислотой или основанием: |
|
|
При реакции с кислотой образуется соль и вода MgO + H2SO4MgSO4 + H2O CuO + 2HCl═ CuCl2 + H2O |
При реакции с основанием образуется соль и вода CO2 + Ba(OH)2 = BaCO3 + H2O SO2 + 2NaOH = Na2SO3 + H2O |
|
Амфотерные оксиды взаимодействуют |
|
|
с кислотами как основные: ZnO + H2SO4 = ZnSO4 + H2O |
с основаниями как кислотные: ZnO + 2NaOH =Na2ZnO2 + H2O (ZnO + 2NaOH + H2O = Na2[Zn(OH)4]) |
|
3. Взаимодействие основных и кислотных оксидов между собой приводит к солям. |
|
|
Na2O + CO2 = Na2CO3 |
|
|
4. Восстановление до простых веществ: |
|
|
3CuO + 2NH3 = 3Cu + N2 + 3H2O P2O5 + 5C = 2P + 5CO |
|
Основания
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Классификация. Растворимые в воде (щёлочи) и нерастворимые. Щёлочи образуют лишь 10 элементов периодической системы химических элементов Д. И. Менделеева: 6 щелочных металлов – литий, натрий, калий, рубидий, цезий, франций и 4 щелочноземельных металла – кальций, стронций, барий, радий.
Амфотерные основания проявляют также свойства слабых кислот.
Получение оснований
1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O = Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 + Cl2
Химические свойства оснований
|
Щёлочи |
Нерастворимые основания |
|
1. Действие на индикаторы. |
|
|
лакмус - синий метилоранж - жёлтый фенолфталеин - малиновый |
|
|
2. Взаимодействие с кислотными оксидами. |
|
|
2KOH + CO2 = K2CO3 + H2O KOH + CO2 = KHCO3 |
|
|
3. Взаимодействие с кислотами (реакция нейтрализации) |
|
|
NaOH + HNO3 = NaNO3 + H2O |
Cu(OH)2 + 2HCl = CuCl2 + 2H2O |
|
4. Обменная реакция с солями |
|
|
Ba(OH)2 + K2SO4 = 2KOH + BaSO4↓ 3KOH+Fe(NO3)3 = Fe(OH)3↓ + 3KNO3 |
|
|
5. Термический распад. |
|
|
|
Cu(OH)2═ CuO + H2O |
Кислоты
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Таблица “Формулы, названия кислот и кислотных остатков”.
|
Кислота |
Кислотный остаток. |
||
|
название |
формула |
название |
формула |
|
Соляная (хлороводородная) |
HCl |
Хлорид |
Cl – |
|
Плавиковая (фтороводородная) |
HF |
Фторид |
F – |
|
Бромоводородная |
HBr |
Бромид |
Br – |
|
Иодоводородная |
HI |
Иодид |
I – |
|
Хлорноватистая |
HClO |
Гипохлорит |
ClO – |
|
Хлорноватая |
HClO3 |
Хлорат |
ClO3 – |
|
Хлорная |
HClO4 |
Перхлорат |
ClO4 – |
|
Азотистая |
HNO2 |
Нитрит |
NO2 – |
|
Азотная |
HNO3 |
Нитрат |
NO3 – |
|
Сероводородная |
H2S |
Сульфид Гидросульфид |
S2 – HS – |
|
Сернистая |
H2SO3 |
Сульфит Гидросульфит |
SO3 2 – HSO3 – |
|
Серная |
H2SO4 |
Сульфат Гидросульфат |
SO4 2 – HSO4 – |
|
Угольная |
H2CO3 |
Карбонат Гидрокарбонат |
СО3 2 – НСО3 – |
|
Кремниевая |
H2SiO3 |
Силикат |
SiO3 2 – |
|
Ортофосфорная |
H3PO4 |
Ортофосфат Гидроортофосфат Дигидроортофосфат |
РО4 3 – НРО4 2 – Н2РО4 – |
|
Муравьиная |
НСООН |
Формиат |
НСОО – |
|
Уксусная |
СН3СООН |
Ацетат |
СН3СОО – |
Классификация кислот
1. По составу: бескислородные и кислородсодержащие.
2. По числу атомов водорода, способных замещаться на металл: одно-, двух-, трёхосновные...
3. По силе. Сильные — диссоциируют практически полностью (HNO3, H2SO4,);
Слабые — константа диссоциации меньше 1·10-3 (например, уксусная кислотаKд= 1,8·10-5).
4. По устойчивости Устойчивые (H2SO4) и неустойчивые (H2CO3, H2SO3 ).
5. По летучести. Летучие (H2S, HCl) и нелетучие.
6. По растворимости в воде Растворимые (H2SO4) и нерастворимые (H2SiO3);
Химические свойства кислот
Взаимодействие с оксидами металлов с образованием солииводы:
![]()
Взаимодействие с амфотерными оксидамис образованиемсолииводы:
![]()
Взаимодействие со щелочамис образованиемсолииводы(реакция нейтрализации):
![]()
Взаимодействие с нерастворимыми основаниямис образованиемсолииводы, если полученная сольрастворима:
![]()
Взаимодействие с солями, если выпадаетосадокили выделяетсягаз:
![]()
Сильные кислоты вытесняют более слабые из их солей:
![]()
(в
данном случае образуется непрочная
угольная
кислота![]() ,
которая сразу же распадается наводуиуглекислый
газ)
,
которая сразу же распадается наводуиуглекислый
газ)
Металлы, стоящие в ряду активностидоводорода, вытесняют его из раствора кислоты (кромеазотной кислоты
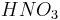 любой
концентрации и концентрированнойсерной
кислоты
любой
концентрации и концентрированнойсерной
кислоты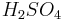 ),
если образующаясясольрастворима:
),
если образующаясясольрастворима:
![]()
С азотной кислотойи концентрированнойсерной кислотамиреакция идёт иначе.
Получение кислот
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 = 2HCl
H2 + S = H2S
3. Реакциями обмена соли с кислотой (вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами):
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3,
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
2NaCl(тв.) + H2SO4(конц.)═ Na2SO4 + 2HCl
По способности вытеснить друг друга из солей кислоты можно расположить в ряд, в котором предшествующие кислоты вытесняют последующие:
H2SO4
 HNO2
CH3COOH
Н2СО3
H2SiO3
HNO2
CH3COOH
Н2СО3
H2SiO3
Уменьшение
силы кислоты
СОЛИ
Солями называются соединения, состоящие из атомов металла и кислотного остатка. Соли можно рассматривать как продукты реакции нейтрализации, в которой атомы водорода кислоты и гидроксогруппы основания соединяются, образуя воду, а атомы металла и кислотный остаток образуют соль:
Ba(OH)2 + H2SO4 BaSO4 + 2H2O.
Классификация солей:
|
СОЛИ |
а) средние или нормальные: Na2CO3, CaCl2, Al2(SO4)3; б) кислые: NaНCO3, К2Н2Р2О7, Ca(Н2РО4)2; в) основные: ZnOНCl, (CuOH)2CО3, [Fe(OH)2]2SO4; г) двойные, тройные и т.д.: NaKCO3, (NH4)2Fe(SO4)2; д) смешанные: MgPO3F, Ca(ClO)Cl; е) комплексные: Na[Al(OH)4], K3[Fe(CN)6]. |
Средние - соли, полученные в результате полного замещения атомов водорода в кислоте на атомы металла, например в реакции нейтрализации: