ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2199
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. В реальных химических процессах из-за неполного протекания реакций и потерь масса продуктов обычно меньше теоретически рассчитаной. Выходом реакции (ŋ) называют отношение реальной массы продукта (mпрактическая) к теоретически возможной (mтеоретическая), выраженное в долях единицы или в процентах:
ŋ= (mпрактическая / mтеоретическая) • 100%.
Если в условиях задач выход продуктов реакции не указан, его в расчетах принимают за 100% (количественный выход).
Пример 1. Сколько г меди образуется при восстановлении 8 г оксида меди водородом, если выход реакции составил 82% от теоретического?
Решение: 1. Рассчитаем теоретический выход меди по уравнению реакции:
CuO + H2 = Cu + H2O
80 г (1 моль) CuO при восстановлении может образовать 64 г (1 моль) Cu; 8 г CuO при восстановлении может образовать Х г Cu
2. Определим, сколько граммов меди образуется при 82% выходе продукта:
6,4 г –– 100% выход (теоретический)
Х г –– 82%
X = (8 • 82) / 100 = 5,25 г
Пример 2. Определите выход реакции получения вольфрама методом алюминотермии, если из 33,14 г концентрата руды, содержащей WO3 и невосстанавливающиеся примеси (массовая доля примесей 0,3) было получено 12,72 г металла.
Решение 1) Определим массу (г) WO3 в 33,14 г концентрата руды:
ω(WO3)= 1,0 - 0,3 = 0,7
m(WO3) = ω(WO3) • mруды = 0,7 • 33,14 = 23,2 г
2) Определим теоретический выход вольфрама в результате восстановления 23,2 г WO3 порошком алюминия:
WO3 + 2Al = Al2O3 + W.
При восстановлении 232 г (1 г-моль) WO3 образуется 187 г (1 г-моль) W, а из 23,2 г WO3 –– Х г W
X = (23,2 • 187) / 232 = 18,7 г W
3) Рассчитаем практический выход вольфрама:
18,7 г W –– 100%
12,72 г W –– Y%
Y = (12,72 • 100) / 18,7 = 68%.
Пример 3. Сколько граммов осадка сульфата бария образуется при сливании растворов, содержащих 20,8 г хлорида бария и 8,0 г сульфата натрия?
Решение. Уравнение реакции:
BaCl2 + Na2SO4 = BaSO4 + 2NaCl.
Расчет количества продукта реакции ведут по исходному веществу, взятому в недостатке.
1). Предварительно определяют, какое из двух исходных веществ находится в недостатке.
Обозначим количество г Na2SO4 –– X.
208 г (1моль) BaCl2 реагирует с 132 г (1 моль) Na2SO4; 20,8 г –– с Х г
X = (20,8 • 132) / 208 = 13,2 г Na2SO4.
Мы установили, что на реакцию с 20,8 г BaCl2 затратится 13,2 г Na2SO4, а дано 18,0 г Таким образом, сульфат натрия взят в реакцию в избытке, и дальнейшие вычисления следует вести по BaCl2, взятому в недостатке.
2). Определяем количество граммов выпавшего осадка BaSO4. 208 г (1 моль) BaCl2 образует 233 г (1 моль) BaSO4; 20,8 г –– Y г
Y = (233 • 20,8) / 208 = 23,3 г.
Закон постоянства состава
Впервые сформулировал Ж.Пруст (1808 г).
Все индивидуальные химические вещества молекулярного строения имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что химические элементы соединяются в определенных количественных соотношениях.
Например, углерод с кислородом образует соединения с различным массовым соотношением элементов углерода и кислорода. СО С : О = 3 : 4 СО2 С : О = 3 : 8 Ни в каких других отношениях углерод с кислородом не соединяются. Это значит, что соединения СО и СО2 имеют постоянный состав, который определяется степенями окисления валентности углерода в соединениях. Валентность каждого элемента имеет определенные значения (их может быть несколько, переменная валентность), поэтому и состав соединений является определенным.
Все вышесказанное относится к веществам молекулярного строения. Так как молекулы имеют определенную химическую формулу (состав), то образуемое ими вещество имеет постоянный состав (совпадающий, очевидно, с составом каждой молекулы). Исключением являются полимеры (состоящие из молекул разной длины).
Сложнее обстоит дело с веществами немолекулярного строения. Речь идет о веществах в конденсированном (твердом и жидком состояниях). Т.к. NaCl – ионное соединение в твердом состоянии (чередование Na+ и Cl–) в газообразном – представляет собой отдельные молекулы NaCl. В капле жидкости или в кристаллике нельзя выделить отдельные молекулы. Например FeO
Fe2+ O2– Fe2+ O2– и т.д. идеальный кристалл
Закон постоянства состава требует, чтобы число ионов Fe2+ точно равнялось числу ионов O2–. А эти числа даже для очень маленьких кристалликов огромны (кубик, ребро 0,001 мм это – 5 1011). Для реального кристалла это невозможно. В реальном кристалле неизбежны нарушения регулярности. Оксид железа (II) может содержать измененное количество кислорода в зависимости от условий получения. Реальный состав оксида выражается формулой Fe1 – хO, где 0,16 х 0,04. Это бертоллид, соединение переменного состава в отличие от дальтонидов с х = 0. При нестехиометрическом составе ионного соединения обеспечивается электронейтральность. Вместо отсутствующего иона Fe2+ присутствуют Fe3+
В атомном (не ионном) веществе, некоторые атомы могут отсутствовать, а некоторые замещать друг друга. Такие соединения также относят к дальтонидам. Формула интерметаллического соединения меди с цинком, которое является составной частью латуни, существующего в интервале составов 40 – 55 ат % Zn можно записать так: (Cu0,.9 – 1,0Zn0,1 – 0)(Cu0 –,0,2Zn0 – 0,8) атомы меди могут замещаться атомами цинка и наоборот.
Закон постоянства состава, таким образом, строго выполняется для веществ молекулярного строения (исключения – высокомолекулярные) и имеет ограниченное применение для немолекулярных веществ.
Массовая доля элемента ω(Э)– это доля одного элемента в общей массе вещества. Вычисляется в процентах или в долях. Обозначают греческой буквой ω (омега). ω показывает, какую часть составляет масса данного элемента от всей массы вещества:
ω(Э) = (n • Ar(Э)) / Mr
где n - число атомов; Ar(Э) - относительная атомная масса элемента; Mr - относительная молекулярная масса вещества.
Зная количественный элементный состав соединения, можно установить его простейшую молекулярную формулу. Для установления простейшей молекулярной формулы:
1) Обозначают формулу соединения Ax By Cz
2) Рассчитывают отношение X : Y : Z через массовые доли элементов:
ω (A) = (х • Ar(А)) / Mr(AxByCz)
ω (B) = (y • Ar(B)) / Mr(AxByCz)
ω (C) = (z • Ar(C)) / Mr(AxByCz)
X = (ω (A) • Mr) / Ar(А)
Y = (ω (B) • Mr) / Ar(B)
Z = (ω (C) • Mr) / Ar(C)
x : y : z = (ω (A) / Ar(А)) : (ω (B) / Ar(B)) : (ω (C) / Ar(C))
3) Полученные цифры делят на наименьшее для получения целых чисел X, Y, Z.
4) Записывают формулу соединения.
Закон кратных отношений
(Д.Дальтон, 1803 г.)
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
N2O N2O3 NO2(N2O4) N2O5
Число атомов кислорода в молекулах этих соединений, приходящиеся на два атома азота, относятся между собой как 1 : 3 : 4 : 5.
Закон объемных отношений
(Гей-Люссак, 1808 г.)
"Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Примеры.
2CO + O2 = 2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
б) При синтезе аммиака из элементов:
N2 + 3H2 = 2NH3
Один объем азота реагирует с тремя объемами водорода; образуется при этом 2 объема аммиака - объем исходной газообразной реакционной массы уменьшится в 2 раза.
«Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде – 12 (12С) массой 0,012 кг (точно). При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц». Речь идет не об углероде вообще, а его изотопе 12С, как и при введении атомной единицы массы. Так как в 12 г углерода 12С содержится 6,02 1023 атомов, то можно сказать, что моль – это количество вещества, содержащее 6,02 1023 своих структурных элементов (атомов или групп атомов, молекул, групп ионов (Na2SO4), комплексных групп и т.д.). Число NA = 6,02 1023 названо постоянной Авогадро. Молярная масса вещества – это масса одного моля. Ее обычная единица измерения г/моль, обозначение М.
Вспомним, что относительная молекулярная масса (Мr) – это отношение массы одной молекулы к массе атомной единицы массы, которая равна 1/NA г.
Пусть относительная молекулярная масса какого-то вещества равна Мr. Вычислим его молекулярную массу М.
Масса
одной молекулы: m
= Мr
а.е.м. = Мr
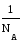 г
г
Масса
одного моль (NA
молекул): М = m
NA
= Мr
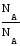 = Мr.
Видим, что численно молярная масса в
граммах совпадает с относительной
молекулярной массой. Это следствие
выбора определенной атомной единицы
массы (1/12 массы изотопа углерода 12С).
= Мr.
Видим, что численно молярная масса в
граммах совпадает с относительной
молекулярной массой. Это следствие
выбора определенной атомной единицы
массы (1/12 массы изотопа углерода 12С).
Закон Авогадро и молярный объем газа
(1811 г.)
Газообразное состояние вещества отличается от конденсированного (жидкого и твердого) сравнительно большими расстояниями между молекулами. На одну молекулу газа приходится объем
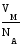 =
=
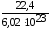 = 3,72 10–23 л = 3,72 10–26 м3 =
= 3,72 10–23 л = 3,72 10–26 м3 =
= 3,72 10–26 (109)3 нм3 = 37,2 нм3
Следовательно,
расстояние между молекулами в среднем
составляют около
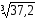 = 3,3 нм. Диаметр молекулы (Н2,О2,N2)составляет
0,2–0,3
нм. Расстояние между молекулами
приблизительно в 10 раз больше диаметра
молекул, а объем, занимаемый некоторой
порцей газа в 1000 раз меньше объема этой
порции. Поэтому объем, занимаемый
некоторым количеством газообразного
вещества, определяется числом молекул
в нем, а не размерами самих молекул, как
это имеет место в жидкости и кристалле,
где молекулы касаются друг друга.
= 3,3 нм. Диаметр молекулы (Н2,О2,N2)составляет
0,2–0,3
нм. Расстояние между молекулами
приблизительно в 10 раз больше диаметра
молекул, а объем, занимаемый некоторой
порцей газа в 1000 раз меньше объема этой
порции. Поэтому объем, занимаемый
некоторым количеством газообразного
вещества, определяется числом молекул
в нем, а не размерами самих молекул, как
это имеет место в жидкости и кристалле,
где молекулы касаются друг друга.
Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул, одинаковое количество (молей) вещества.
Закон справедлив только для газообразных веществ.