ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2165
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
3Mg(OH)2 + 2H3PO4 Mg3(PO4)2 + 6H2O.
При диссоциации дают только катионы металла (или NH4+)
Na2SO4 = 2Na+ +SO42-
CaCl2 = Ca2+ + 2Cl-
Кислые соли - продукты неполного замещения атомов водорода многоосновной кислоты на атомы металла. Кислые соли могут образовывать двух и более основные кислоты, как кислородсодержащие, так и бескислородные кислоты. Гидрогруппа принадлежит аниону:
Mg(OH)2 + H3PO4 MgНPO4 + 2H2O.
. При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка.
NaHCO3 = Na+ + HCO3- = Na+ + H+ + CO32-
.
Основные соли - продукты неполного замещения групп OH соответствующего основания на кислотные остатки:
Fe(OH)3 + HCl Fe(ОН)2Cl + H2O.
Основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп. Гидроксогруппа принадлежит аниону. При диссоциации дают катионы металла, анионы гидроксида и кислотного остатка.
Zn(OH)Cl = [Zn(OH)]+ + Cl- = Zn2+ + OH- + Cl-
Двойные. При диссоциации дают два катиона и один анион.
KAl(SO4)2 = K+ + Al3+ + 2SO42-
Смешанные. Образованы одним катионом и двумя анионами:
CaOCl2 = Ca2+ + Cl- + OCl-
Комплексные. Содержат сложные катионы или анионы: [Ag(NH3)2]Br, Na[Ag(CN)2]
Название средней соли по международной номенклатуре состоит из латинского названия кислотного остатка и названия металла в родительном падеже, причем для металлов, проявляющих разные степени окисления, указывают степень окисления. При этом следует помнить, что кислотные остатки кислородсодержащих кислот содержат суффикс «-ат», если образующий кислоту элемент имеет высшую степень окисления, и «-ит» – в случае более низкой степени окисления элемента, например:
Zn(N+5O3)2 – нитрат цинка, Zn(N+3O2)2 – нитрит цинка.
Приставка «пер-» указывает на самую высокую степень окисления элемента, приставка «гипо-» указывает на его самую низкую положительную степень окисления. Систему названий кислотных остатков можно показать на примере названий солей элементов VII группы:
KCl+7O4 – перхлорат; KMn+7O4 – перманганат;
KCl+5O3 – хлорат; K2Mn+6O4 – манганат;
KCl+3O2 – хлорит; K2MnO3 – манганит;
KCl+1O – гипохлорит.
Приставки «мета-», «орто-», «ди-», «три-» и т. д. переходят в название кислотного остатка из названия кислоты:
NaBO2 – метаборат натрия, Na4P2O7 – дифосфат натрия.
Кислотные остатки бескислородных кислот имеют суффикс «-ид»:
AgBr – бромид серебра, CaCl2 – хлорид кальция.
Названия кислых солей составляют, добавляя к названию кислотного остатка приставки «гидро-», «дигидро-» и т. д., которая отражает число незамещенных на металл атомов водорода:
NaHSO3 – гидросульфит натрия, NaH2PO4 – дигидрофосфат натрия.
Названия основных солей содержат приставку «гидроксо-», «дигидроксо-» и т. д. перед названием металла, которая отражает число незамещенных на кислотный остаток гидроксогрупп:
AlOHSO4 – сульфат гидроксоалюминия, [Fe(OH)2]2SO4 – сульфат дигидроксожелеза (III).
Средние соли
Получение
Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
Металла с неметаллом:
2Na + Cl2 = 2NaCl
Металла с кислотой:
Zn + 2HCl = ZnCl2 + H2
Металла с раствором соли менее активного металла
Fe + CuSO4 = FeSO4 + Cu
Основного оксида с кислотным оксидом:
MgO + CO2 = MgCO3
Основного оксида с кислотой
CuO + H2SO4═ CuSO4 + H2O
Основания с кислотным оксидом
Ba(OH)2 + CO2 = BaCO3↓ + H2O
Ооснования с кислотой:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Раствора основания с раствором соли:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓
Растворов двух солей
3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl
Химические свойства солей
1.Термическое разложение.
CaCO3 = CaO + CO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
NH4Cl = NH3 + HCl
2.Обменные реакции с кислотами, основаниями и другими солями.
AgNO3 + HCl = AgCl + HNO3
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl
3. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона (подробнее рассматриваются позже).
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
4. Гидролиз (подробнее рассматривается позже).
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
FeCl3 + H2O = Fe(OH)Cl2 + HCl
Na2S + H2O = NaHS +NaOH
Кислые соли
Получение
1.Взаимодействие кислоты с недостатком основания.
KOH + H2SO4 = KHSO4 + H2O
2. Взаимодействие основания с избытком кислотного оксида
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3.Взаимодействие средней соли с кислотой
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Химические свойства.
1.Термическое разложение с образованием средней соли
Ca(HCO3)2 = CaCO3 + CO2 + H2O
2.Взаимодействие со щёлочью. Получение средней соли.
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Основные соли
Получение
1.Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O = [Zn(OH)]Cl + HCl
2.Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов
AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Химические свойства.
1.Термическое разложение.
[Cu(OH)]2CO3(малахит) = 2CuO + CO2 + H2O
2.Взаимодействие с кислотой: образование средней соли.
Sn(OH)Cl + HCl = SnCl2 + H2O
Взаимные превращения и способы получения кислых, средних и основных солей можно представить схемой:
щелочь
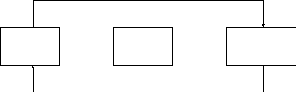
КИСЛЫЕ  СРЕДНИЕ
СРЕДНИЕ ОСНОВНЫЕ
ОСНОВНЫЕ
СОЛИ
 СОЛИ
СОЛИ СОЛИ
СОЛИ
кислота
Рассмотрим на примерах все возможные взаимные превращения кислых, средних и основных солей:
(2) (3)
Fe(HSO4)2
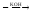 FeSO4
FeSO4
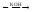 (FeOH)2SO4.
(FeOH)2SO4.
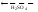
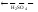
(4)
FeSO4 + H2SO4 Fe(HSO4)2.
Fe(HSO4)2 + 2KOH FeSO4 + K2SO4 + 2H2O.
2FeSO4 + 2KOH (FeOH)2SO4 + K2SO4.
(FeOH)2SO4 + H2SO4 2FeSO4 + 2H2O.
ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ РАЗЛИЧНЫМИ КЛАССАМИ СОЕДИНЕНИЙ
|
|
Графическое изображение формул
При составлении графических формул не учитывают характер связи в соединениях, а исходят из степени окисления атомов, входящих в состав веществ. Количество черточек, соединяющих атомы, должно совпадать с их степенями окисления. Составление графических формул позволяет глубже понять взаимосвязь между веществами, относящимися к различным классам неорганических соединений.
Например:
основания: NaOH, Ca+2(OH)2, Al+3(OH)3
O–2
– H+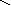
Na+1 – O–2 – H+ H – O – Ca+2 – O–2 – H+ H – O – Al+3
O – H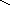
кислоты: HNO3, H2SO4, H3PO4
O–2
H+
– O–2
O–2
H+
– O–2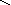
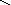
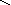
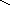
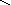
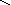
H+
– O–2
– N+5
S H+
– O–2
– P+5
= O–2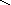
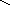
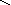
O–2
H+
– O–2
O–2
H+
– O–2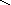
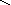
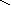
соли: CaSO4, Na3PO4, NaNO3
O–2
O Na – O O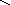
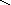
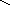
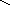
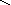
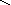
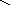
Ca+2
S Na – O – P = O Na – O – N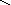
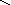
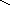
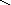
O–2
O Na – O O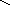
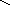
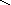
(FeOH)2SO4 Fe(H2PO4)2
H –
O – Fe – O O O – H H – O