ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2164
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
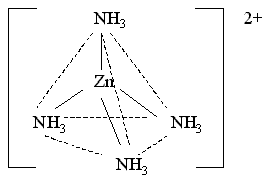
Поскольку в ионе [Zn(NH3)4]2+ нет неспаренных электронов, то он проявляет диамагнитные свойства.
Тетрахлороманганат(II)-ион [MnCl4]2 содержит пять неспаренных электронов на 3d-орбитали и вакантные 4s- и 4p-орбитали. Вакантные орбитали образуют sp3-гибридные орбитали, которые перекрываются с p-атомными орбиталями хлорид-ионов:
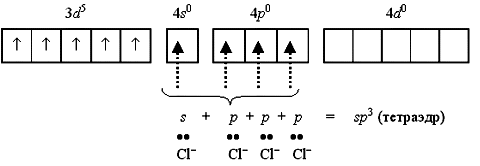
Полученный таким образом тетраэдрический ион [MnCl4]2 является парамагнитным, так как содержит пять неспаренных электронов.
2. Гибридизация орбиталей и структура комплексов
Применяя обычный алгоритм предсказания типа гибридизации атомных орбиталей в рамках метода валентных связей, можно определить геометрию комплексов разного состава. Для этого, прежде всего, необходимо написать электронную формулу валентного уровня и построить схему распределения электронов по квантовым ячейкам. Например, для нейтрального атома никеля:
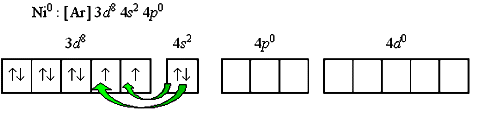
Переход 4s-электронов на 3d-подуровень превращает парамагнитный атом Ni0 в диамагнитную частицу Ni*:
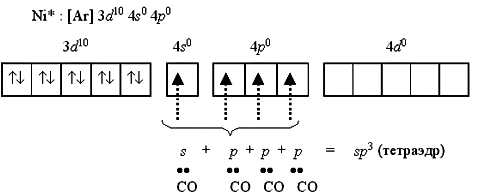
Полученные вакантные орбитали подвергаются гибридизации, образуя тетраэдрическую конфигурацию. Так построен тетраэдрический диамагнитный комплекс тетракарбонилникель [Ni(CO)4] (КЧ = 4), который характеризуется значительной устойчивостью.
Если комплексообразователем служит никель(II) с электронной конфигурацией [Ar]3d84s0 4p0, то надобность в перемещении электронов с 4s-подуровня перед гибридизацией отпадает, так как для реализации координационного числа 4 имеется достаточное число вакантных орбиталей:
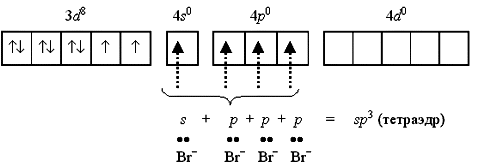
Такое строение имеет неустойчивый парамагнитный комплекс тетрабромоникколат(II)-ион [NiBr4]2. Однако при объединении двух электронов 3d-подуровня в пару и превращении одной из квантовых ячеек этого подуровня в вакантную меняется и тип гибридизации, и характеристика получаемого комплекса:
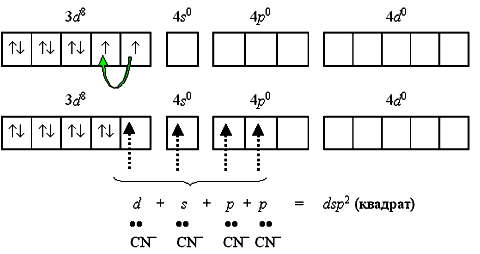
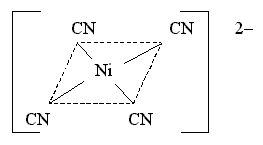
Тип гибридизации dsp2 и плоскоквадратная форма комплекса реализуются при образовании устойчивого диамагнитного комплекса тетрацианоникколат(II)-иона [Ni(CN)4]2 (КЧ = 4):
Если синтез цианидного комплекса вести в условиях избытка лиганда, можно реализовать координационное число 5:
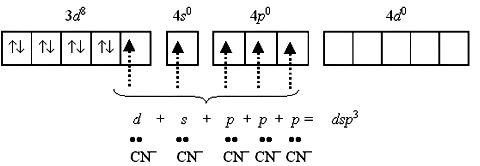
Устойчивый диамагнитный комплекс пентацианоникколат(II)-ион [Ni(CN)5]3 имеет форму квадратной пирамиды:
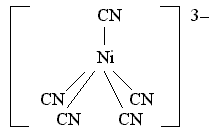
Октаэдрический
комплекс никеля(II) [Ni(H2O)6]2+,
хотя и парамагнитен,
но достаточно устойчив. Его образование
обусловлено sp3d2-гибридизацией
атомных орбиталей никеля:
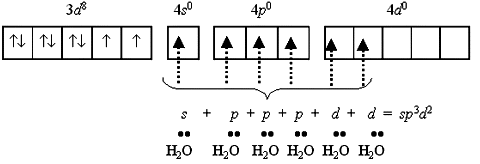
Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, комплекс, как правило, в значительной степени парамагнитен и называется внешнеорбитальным или высокоспиновым. Строение таких комплексов может отвечать типу гибридизации, например, sp3d2.
Такие комплексы, при образовании которых имеет место гибридизация с участием атомных орбиталей предвнешнего d-подуровня, называются внутриорбитальными или низкоспиновыми и, как правило диамагнитны или слабо парамагнитны (все или почти все электроны комплексообразователя спарены, а тип гибридизации, например, d2sp3 или dsp2).
При рассмотрении комплексов железа(II) обнаруживаются и внешнеорбитальные, и внутриорбитальные комплексы.
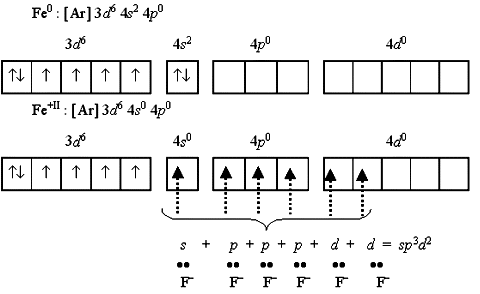
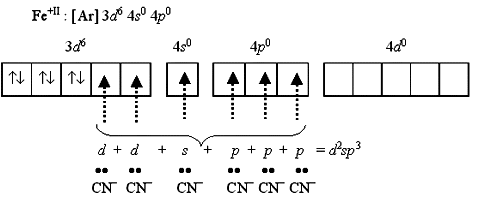
Приведенная схема показывает, как образуются парамагнитный высокоспиновый гексафтороферрат(II)-ион [FeF6]4 и диамагнитный низкоспиновый гексацианоферрат(II)-ион [Fe(CN)6]4.
Сама по себе теория валентных связей не дает ответа на вопрос, какой вид комплекса образуется в каждом конкретном случае, так как этот метод не учитывает влияния природы лиганда. Поэтому метод валентных связей должен обязательно дополняться данными о магнитных свойствах комплекса либо сведениями о влиянии лиганда на характер образующегося комплекса.
3. Теория кристаллического поля.
Теория кристаллического поля пришла на смену теории валентных связей в 40-х годах XX столетия. В чистом виде она сейчас не применяется, так как не может объяснить образование ковалентных связей в комплексных соединениях и совершенно не учитывает истинного состояния лигандов (например, их действительных размеров) даже в случае взаимодействий, близких к чисто электростатическим.
Уже с середины 50-х годов упрощенная теория кристаллического поля была заменена усовершенствованной теорией поля лигандов, учитывающей ковалентный характер химических связей между комплексообразователем и лигандом.
Однако наиболее общий подход к объяснению образования комплексных соединений дает теория молекулярных орбиталей (МО), которая в настоящее время превалирует над всеми остальными. Метод молекулярных орбиталей предусматривает и чисто электростатическое взаимодействие при отсутствии перекрывания атомных орбиталей, и всю совокупность промежуточных степеней перекрывания.
Рассмотрим основные понятия теории кристаллического поля, которая, как и теория валентных связей, все еще сохраняет свое значение для качественного описания химических связей в комплексных соединениях из-за большой простоты и наглядности.
В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается.
Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и прежде всего d-подуровни расщепляются, и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов ( октаэдрическое, тетраэдрическое или иное кристаллическое поле ). Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6]3 или [Co(NH3)6]3+). В центре октаэдра находится атом-комплексообразователь М(+x) с электронами на d-атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F или полярные молекулы типа NH3). В условном ионе М(+x), не связанном с лигандами, энергии всех пяти d-АО одинаковы (т.е. атомные орбитали вырожденные).
Однако в октаэдрическом поле лигандов d-АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d(z2) и d(x2 y2), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов. Физической моделью такого взаимодействия может служить сильно сжатая пружина.
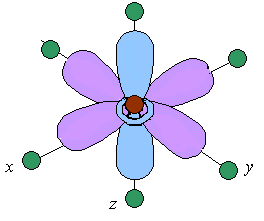

Другие три d-АО – d(xy), d(xz) и d(yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от них. Взаимодействие таких d-АО с лигандами минимально, а следовательно – энергия d(xy), d(xz) и d(yz)-АО понижается по сравнению с исходной.
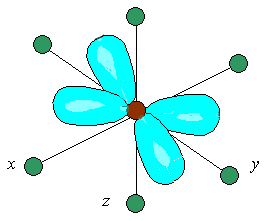

Таким образом, пятикратно вырожденные d-АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы новых орбиталей – трехкратно вырожденные орбитали с более низкой энергией, d(xy), d(xz) и d(yz), и двукратно вырожденные орбитали с более высокой энергией, d(z2) и d(x2y2). Эти новые группы d-орбиталей с более низкой и более высокой энергией обозначают d и d:
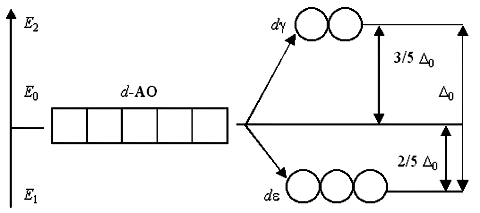
Разность энергий двух новых подуровней d и d получила название параметра расщепления 0:
E2 – E1 = 0
Расположение двух новых энергетических подуровней d и d по отношению к исходному (d-АО) на энергетической диаграмме несимметричное:
(Е2 – Е0) (Е0 – Е1).
Квантово-механическая теория требует, чтобы при полном заселении новых энергетических уровней электронами общая энергия осталась без изменения, т.е. она должна остаться равной Е0. Иначе говоря, должно выполняться равенство