ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2180
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
б) Побочное, или орбитальное, квантовое число (l). В спектрах многоэлектронных атомов наблюдается мультиплетная структура линий, т.е. линии расщеплены на несколько компонент. Мультиплетность линий означает, что энергетические уровни представляют собой совокупности энергетических подуровней, т.к. любой линии в спектре отвечает переход электрона из одного состояния в другое. Энергетические различия в состоянии электронов в данном уровне связаны с различием в форме электронных облаков.
Для характеристики энергетических подуровней используется орбитальное квантовое число l. Оно может принимать в пределах каждого уровня целочисленные значения от 0 до n–1. Таким образом, уровень в зависимости от l подразделяется на подуровни, которые имеют также буквенные обозначения: s (l=0), p (l=1), d (l=2), f (l=3). Электроны, находящиеся в этих состояниях, называются s-, p-, d- и f-электронами.
Форма s-электронного облака. Это облако обладает сферической симметрией, т.е. имеет форму шара. График волновой функции ψ расположен по одну сторону от оси абсцисс (рисунок 3), т.е. волновая функция s-электрона положительна.
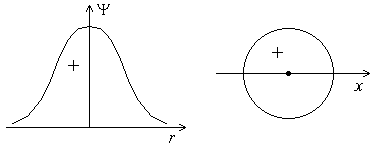
Рисунок 3 – График волновой функции s-электрона в зависимости от расстояния до ядра. Форма s-орбитали
Форма p-электронного облака. Для p-электрона при удалении от ядра по некоторому направлению волновая функцияимеет перегиб (рисунок 4). По одну сторону от ядра положительна, а по другую – отрицательна (не путать знак волновой функции со знаком электрического заряда!). В начале координат обращается в нуль. В отличие от s-орбитали, p-орбиталь не обладает сферической симметрией, а имеет форму, напоминающую гантель (рисунок 4
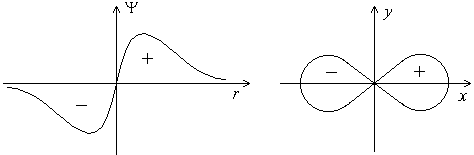
Рисунок 4 – График волновой функции p-электрона. Форма p-электронного облака
Знаки “+” и “–” относятся не к вероятности нахождения электрона (она всегда положительна и равна 2), а к волновой функции, которая в разных частях электронного облака имеет различный знак.
Еще более сложную формуимеют электронные облака d- и f-электронов. Например,d-орбитали могут иметь четырехлепестковое строение, причем знаки волновой функции в “лепестках” чередуются:
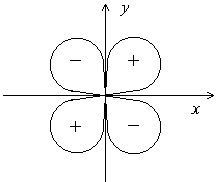
в) Магнитное квантовое число(ml). Если атом поместить во внешнее магнитное поле, то происходит дальнейшее расщепление спектральных линий. Это означает, что при данных значенияхn и l может существовать несколько состояний электрона с одинаковой энергией. Такие энергетические состояния называются вырожденными.Вырождение исчезает при воздействии на атом внешнего магнитного поля, что и приводит к появлению новых линий в спектре.
Энергетические изменения под действием магнитного поляобъясняются различием в характерерасположения электронных облаков в пространствеи, следовательно, их различной ориентацией по отношению к силовым линиям поля. Магнитное квантовое числоml для данного подуровня – это целочисленная величина в диапазоне от –l до +l. Таким образом, при данном l оно имеет (2l+1) различных значений. Например, для s-подуровня (l=0) имеется только одно значение ml, равное нулю. Поэтому s-подуровень содержит единственную орбиталь. Для p-подуровня (l=1) возможны три значения: ml:{–1,0,1}. В соответствии с этим каждый p-подуровень состоит из трех орбиталей гантелеобразной формы, ориентированных перпендикулярно друг другу вдоль трех координатных осей и обозначаемых px, py, pz. Легко определить, что на d-подуровне (l=2) содержится 2l+1=5 орбиталей, а на f-подуровне (l=3) – 7 орбиталей.
На рисунке 5 показано постепенное усложнение представлений о структуре электронной оболочки атома (от уровней к подуровням и далее к орбиталям).
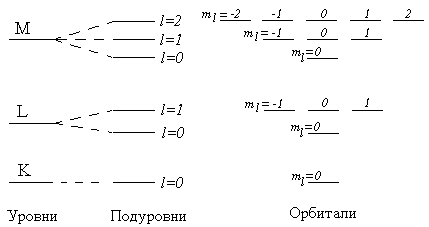
Рисунок 5 –Энергетическая диаграмма уровней с 1-го по 3-й
г) Спиновое квантовое число(ms) не связано с движением электрона вокруг ядра, а определяет его собственное состояние. Природа этого состояния неизвестна до сих пор. Предполагается, что она связана с вращением электрона вокруг собственной оси"Spin" в переводе с английского ‑"кружение", "верчение".. Число ms принимает два значения: +1/2 и –1/2.
Для определения состояния электрона в многоэлектронном атоме важное значение имеет принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь, характеризующаяся определенными значениями n, l и ml, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными.
Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждомподуровне, т.е. определить емкость подуровней:
![]()
Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа.
Электронная структура атомов и периодическая система элементов
При l=0, т.е. на s-подуровне, имеется всего однаорбиталь , которую принято изображать в виде клетки. В атоме Нединственныйэлектроннаходится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой:
![]()
В атоме гелия, порядковый номер которого впериодической системе(или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия:
![]()
У этого атома завершается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов.
Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами(подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
У следующего за гелием элемента лития(Z=3) третий электрон уже не может разместиться на орбитали K-слоя.K-слоем называется первый электронный слой атома.: это противоречило бы принципу Паули. Поэтому он занимает s-состояние второго энергетического уровня (L-слой.L-слоем называется второй электронный слой атома., n=2). Его электронная структура записывается формулой 1s22s1, что соответствует схеме:
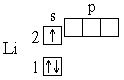
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:
![]()
Для атома углеродауже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
![]()
Анализ атомного спектра показывает, что правильна последняя схема. Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спинаатома максимально. Пользуясь правилом Хунда, нетрудно составить схему электронного строения для атома азота (Z=7):
![]()
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
O 1s22s22p4; F 1s22s22p5; Ne 1s22s22p6
У атома неоназаканчивается заполнение второго энергетического уровня, и завершается построение второго периодасистемы элементов.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Такие элементы называются s-элементами. Говоря по-другому, они относятся к семейству s-элементов. (т.е. они относятся к s-семейству элементов). Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Это атомы p-элементов (принадлежат к p-семейству). Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядраэлектронная структура внешних слоев атомов периодически повторяется. Однако электронное строение атомов определяет свойства элементов и их соединений. В этом состоит сущностьпериодического закона: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра.
У атома аргонаостаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов –калияикальция– заполнение 3-го электронного слоя временно прекращается, и начинает формироваться s-подуровень 4-го слоя. Такой порядок заполнения вытекает изпервого правила Клечковского: при увеличении заряда ядра атомов заполнение энергетических уровней происходит от орбиталей с меньшим значением суммы главногоиорбитальногоквантовых чисел (n+l) к орбиталям с большим значением этой суммы. Следовательно, 4s-подуровень (n+l=4) должен заполняться раньше, чем 3d (n+l=5). Для атома скандиявозникает вопрос: какой из подуровней должен заполняться – 3d или 4p, т.к. сумма n+l для них одинакова и равна 5. В подобных случаях порядок заполнения определяетсявторым правилом Клечковского, согласно которому при одинаковых значениях суммы (n+l) орбитали заполняются в порядке возрастания главного квантового числа n. Заполнение 3d-подуровня происходит у десяти элементов от ScдоZn. Это атомы d-элементов. Затем начинается формирование 4p-подуровня (p-элементы от Ga до Kr). Как и атомы предшествующихблагородных газов– неона и аргона – атомкриптонахарактеризуется структурой внешнего электронного слоя ns2np6.