ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2229
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
4..Моляльная концентрация b – число молей растворенного вещества в одном килограмме растворителя.
b
(X) =
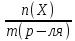 =
=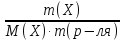
где n(X) – число молей вещества X; m – масса вещества Х; М – молярная масса вещества Х; m(р-ля) –массарастворителя , кг. Измеряют моляльность в моль/кг.
Мольная доля χ–это отношение количества компонента, содержащегося в данной системе ( в молях), к общему количеству веществ в системе ( в молях). Выражают в долях единицы или процентах
(Х)
=
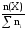 ,
,
где
n(Х) количество вещества
Х в растворе, моль;ni– количество вещества каждого компонента
раствора, моль. Для двухкомпонентного
раствора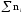 =n(Х) +n(S),
гдеn(S) –
количество вещества растворителяS.
Мольная доля также выражается в долях
единицы или процентах. Сумма массовых
(мольных) долей всех компонентов раствора
равна 1.
=n(Х) +n(S),
гдеn(S) –
количество вещества растворителяS.
Мольная доля также выражается в долях
единицы или процентах. Сумма массовых
(мольных) долей всех компонентов раствора
равна 1.
6 Очень часто в аналитической химии используют такой способ выражения концентраций раствора как титр: определяется числом граммов растворённого вещества в 1 мл раствора. Титрованные, или стандартные растворы – это растворы с точно известным содержанием вещества. Без таких растворов невозможно представить проведение химического анализа.
Пример 1.Найти молярную концентрацию раствора с массовой долей 15%H2SO4и плотностью1,10 г/мл.
Решение.
Пусть Vр-ра = 1 л = 1000 мл.
Найдем массу 1 л раствора:
m р-ра = р-ра Vр-ра = 1,10 г/мл 1000 мл = 1100 г.
Найдем массу H2SO4 в 1 л раствора:
m(H2SO4) = m р-ра = 0,15 1100 = 165 г.
Найдем молярную концентрацию:
С
H SO
SO =
=
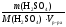 =
=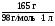 = 1,68 моль/л.
= 1,68 моль/л.
Пример 2. Сколько миллилитров 30%-ного раствора HCl (плотность 1,150 г/мл) нужно для приготовления 1 л 0,1 н. раствора HCl?
Решение.
Найдем массу соляной кислоты, которая должна содержаться в приготовленном растворе:
m(HCl)
= C(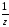 HCl)
M(
HCl)
M(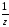 HCl)
Vр-ра,
HCl)
Vр-ра,
где
M(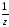 HCl)
= 1
M(HCl)
= 36,5 г/моль.
HCl)
= 1
M(HCl)
= 36,5 г/моль.
m(HCl) = 0,1 36,5 1 = 3,65 г.
Поскольку раствор готовят разбавлением водой 30%-го раствора, то такая же масса HCl должна содержаться в 30%-м растворе. Найдем массу 30%-го раствора, содержащую 3,65 г HCl:
(HCl)
=
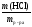
mр-ра
=
mр-ра
=
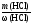 =
=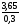 = 12,167 г.
= 12,167 г.
Найдем объем 30%-го раствора:
V
=
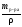 =
=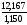 = 10,58
мл.
= 10,58
мл.
Пример 3. Сколько граммов Na2SO4 10H2O надо растворить в 800 г воды, чтобы получить раствор с массовой долей Na2SO4 10%?
Решение.
Обозначим массу кристаллогидрата за х:
m(Na2SO4 H2O) = х(г), тогда
(Na2SO4)
=
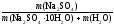 =
=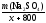 = 0,1.
= 0,1.
Выразим
массу Na2SO4,
содержащуюся в х
г кристаллогидрата, используя молярные
массы М(Na2SO4)
= 142 г/моль МNa SO
SO
H
H O
= = 142 + 180 = 322 г/моль.
O
= = 142 + 180 = 322 г/моль.
322 г Na2SO4 H2O содержат 142 г Na2SO4,
х
г Na2SO4
H2O
содержат m
г Na2SO4
m(Na2SO4)
=
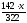 .
.
Подставим m(Na2SO4) в выражение для и найдем х:
(Na2SO4)
=
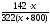 = 0,1;
= 0,1;
142 х = 0,1 322 (800 + х) = 25 760 + 32,2х;
109,8х = 25 760, х = 234,6.
m(Na2SO4 H2O) = 234,6 г.
Пример 4. Сколько граммов СаСО3 выпадет в осадок, если к 800 мл 0,5 н. раствора СаСl2 прибавить избыток раствора соды?
Решение. При сливании растворов СаСl2и соды (Nа2СО3) протекает реакция обмена: СаСl2+Nа2СО3= СаСО3+ 2NaCl.
Для решения задачи будем использовать закон эквивалентов: при взаимодействии количества веществ эквивалентов разных веществ одинаковы, т.е.
n(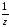 СаСО3)
= C(
СаСО3)
= C(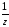 СаСl2)
Vр-ра
= 0,5
0,8 = 0,4 моль.
СаСl2)
Vр-ра
= 0,5
0,8 = 0,4 моль.
Найдем
массу СаСО3,
М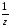 СаСО3
=
СаСО3
=
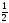
100 г/моль:
100 г/моль:
m(СаСО3)
= n(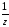 СаСО3)
М
СаСО3)
М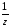 СаСО3
= 0,4
СаСО3
= 0,4
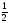
100 = 20 г.
100 = 20 г.
V
=
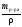 =
=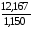 = 10,58 мл.
= 10,58 мл.
Концентрация компонента в растворе может изменяться от нуля до некоторого максимального значения, называемого растворимостью компонента. Растворимость S – концентрация компонента в насыщенном растворе. Насыщенный раствор – раствор, находящийся в равновесии с растворенным веществом. Величина растворимости характеризует равновесие между двумя фазами, поэтому на неё влияют все факторы, смещающие это равновесие (в соответствии с принципом Ле Шателье ).
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Количество тепла, поглощаемого или выделяемого при растворении 1 молявещества, называетсятеплотой растворения(∆Hs). При растворении твердого вещества происходит разрушениекристаллической решетки. На это требуется затрата энергии. Однако многие процессы растворения протекают с выделением тепла, т.е. эти процессы являются экзотермическими. (∆Hs<0). Поэтому можно предположить, что наряду с разрушением кристаллической решетки протекает экзотермический процесс. Было показано, что этим процессом являетсясольватация, т.е. соединение молекул растворенного вещества в неустойчивые соединения –сольваты. Когда растворителем является вода, то эти соединения называются гидратами, а процесс –гидратацией. Поскольку молекула воды оченьполярна, то многие гидраты весьма устойчивы и могут быть выделены в кристаллическом состоянии (кристаллогидраты), например CuSO4∙5H2O – медный купорос, Na2CO3∙10H2O – кристаллическая содаи др.
В общем случае при растворении происходит изменение свойств и растворителя, и растворенного вещества, что обусловлено взаимодействием частиц между собой по различным типам взаимодействия: Ван-дер-Ваальсового (во всех случаях), ион-дипольного (в растворах электролитов в полярных растворителях), специфических взаимодействий (образование водородных или донорно-акцепторных связей). Учет всех этих взаимодействий представляет собой очень сложную задачу. Очевидно, что чем больше концентрация раствора, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора. Поэтому количественная теория разработана только для идеальных растворов, единственной движущей силой образования такого раствора является увеличение энтропии системы ΔS; какие-либо тепловые или объемные эффекты при растворении отсутствуют (ΔН = 0, ΔV = 0. К идеальным можно отнести газовые растворы и растворы неполярных жидкостей, в которых энергия взаимодействия разнородных частиц EA-B близка к энергиям взаимодействия одинаковых частиц EA-A и EB-B. Идеальными можно считать также бесконечно разбавленные растворы, в которых можно пренебречь взаимодействием частиц растворителя и растворенного вещества между собой. Свойства таких растворов зависят только от концентрации растворенного вещества, но не зависят от его природы.
Растворимость газов в газах
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях (при очень высоких давлениях, когда плотность газов приближается к плотности жидкостей, может наблюдаться ограниченная растворимость). Газовые смеси описываются законом Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов.
Pобщ. = Pi
Pi = χi P
Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0,017 л. азота, 748,8 л. аммиака или 427,8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона:
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
![]()
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях существенно зависит от температуры;
Как
правило, при растворении газа в жидкости
выделяется теплота(Н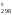 <0),
поэтому с повышением температуры
растворимость уменьшается.
<0),
поэтому с повышением температуры
растворимость уменьшается.
Взаимная растворимость жидкостей
В зависимости от природы жидкости могут смешиваться в любых соотношениях (в этом случае говорят о неограниченной взаимной растворимости), быть практически нерастворимыми друг в друге либо обладать ограниченной растворимостью. Рассмотрим последний случай на примере системы анилин – вода. Если смешать примерно равные количества воды и анилина, система будет состоять из двух слоев жидкости; верхний слой – раствор анилина в воде, нижний – раствор воды в анилине. Для каждой температуры оба раствора имеют строго определенный равновесный состав, не зависящий от количества каждого из компонентов.