ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2251
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Растворимость AgCl в чистой воде:
Со =√ПР = √1,56·10-10 = 1,25·10-5 моль/л.
Увеличение
концентрации ионов Cl‑
за счет введения в раствор NaCl
приведет к смещению равновесия (3) влево,
к уменьшению концентрации ионов Ag+
за счет образования дополнительного
количества осадка. Равновесная
концентрация ионов Cl‑будет
слагаться из концентрации ионов Cl‑
за счет диссоциации растворенной части
AgCl
и ионов Cl-,
образующихся за счет диссоциации NaCl:
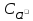 =
=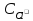 (изAgCl)
+
(изAgCl)
+
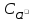 (изNaCl).
Хлорид натрия хорошо растворим и является
сильным электролитом: NaCl
→ Na+
= Cl‑
; α
= 1. Концентрацией Cl‑,
образующихся за счет равновесия (3) можно
пренебречь, так как она незначительна
в сравнении с концентрацией Cl‑,
образующихся при диссоциации:
(изNaCl).
Хлорид натрия хорошо растворим и является
сильным электролитом: NaCl
→ Na+
= Cl‑
; α
= 1. Концентрацией Cl‑,
образующихся за счет равновесия (3) можно
пренебречь, так как она незначительна
в сравнении с концентрацией Cl‑,
образующихся при диссоциации:
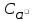 (изAgCl)
<<
(изAgCl)
<<
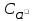 (изNaCl).
При растворении AgCl
в 0,1 М растворе NaCl
произведение растворимости AgCl
не изменится.
(изNaCl).
При растворении AgCl
в 0,1 М растворе NaCl
произведение растворимости AgCl
не изменится.
Обозначим растворимость AgCl в 0,1 М растворе NaCl через С1 (моль/л). Тогда СAg+ = С1·α = С1.
ПР = С1· 0,1 = 1,56·10-10.
С1
=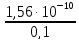 = 1,56·10-9
моль/л.
= 1,56·10-9
моль/л.
Значение С1 значительно меньше Со.
Значения ПР используются также для определения условий образования осадков. Рассмотрим возможность образования осадка МхАy:
x{My+}aq
+ y{Ax-}aq
![]() [МхАy].
[МхАy].
Обозначим произведение произвольно выбранных концентраций ионов, входящих в выражение константы равновесия как ПС:
ПС = СхMy+·СуAx- .
Условием образования в системе осадка является неравенство ПС МхАy > ПР МхАy, т.е. осадок выпадает в том случае, когда произведение концентраций ионов, образующих малорастворимый электролит, в степенях, равных стехиометрическим коэффициентам, будет больше произведения растворимости. При ПС МхАy < ПР МхАy осадок в системе не образуется.
ПРИМЕР 4. Будет ли выпадать осадок при смешивании 100 мл 0,02М раствора нитрата свинца с 200 мл 0,2н. раствора соляной кислоты.
РЕШЕНИЕ. В осадок может выпасть малорастворимый PbCl2. В исходных растворах концентрация ионов Pb2+ = 0,02моль/л, CCl- = 0,2 моль/л. При смешивании растворов концентрация ионов Pb2+ уменьшится в 3 раза и составит 0,02/3 = 0,0067 моль/л, CCl- =0,2·2/3 = 0,133 моль/л, поскольку раствор, содержащий Cl- ионы разбавили от 200 до 300 мл.
ПС PbCl2= СPb2+·С2Cl- = 0,0067 · (0,133)2 = 1,19·10-4.
ПР PbCl2 = 2,12·10-5. ПСPbCl2 > ПРPbCl2. Осадок выпадает
Гидролиз солей
Обменное взаимодействие соли с водой, приводящее к образованию слабого электролита, называется гидролизом солей. Суть гидролиза солейзаключается в том, что происходит смещение равновесиядиссоциации водывследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого продукта. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль.
Гидролизу подвергаются растворимые соли, образованные:
а) слабой кислотой и сильным основанием;
б) слабым основанием и сильной кислотой;
в) слабым основанием и слабой кислотой.
В гидролизе участвуют катионы слабого основания и анионы слабой кислоты, в большинстве случаев гидролиз – процесс обратимый, протекает ступенчато. Гидролиз приводит к изменению рН среды.
Уравнения реакций гидролиза составляют в молекулярной и ионно-молекулярной формах.
Соли, образованные слабым основанием и сильной кислотой, и соли, образованные слабой кислотой и сильным основанием, в обычных условиях подвергаются гидролизу в незначительной степени. Вторая и последующие ступени, если они возможны, почти не протекают, поэтому при рассмотрении процесса гидролиза, выше названных солей ограничиваются первой ступенью.
Например, гидролиз соли Na2CO3в растворе:
|
Na2CO3 |
NaOH– сильное основание H2CO3– слабая кислота |
Na+
+ CO |
гидролизу подвергается анион слабой кислоты:
CO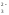 +H2O
+H2O![]() HCO
HCO + ОН-(Іступень);
+ ОН-(Іступень);
в молекулярной форме:
Na2CO3+H2ONaНCO3+NaОН;
в растворе соли избыток ионов ОН-, среда щелочная, рН7.
Гидролиз соли ZnSO4в растворе:
|
ZnSO4 |
Zn(OH)2– слабое основание H2SO4– сильная кислота |
Zn2+
+ SO |
гидролизу подвергается катион слабого основания:
Zn2++H2O![]() ZnОН++ Н+(Іступень);
ZnОН++ Н+(Іступень);
в молекулярной форме:
2ZnSO4+ 2H2O![]() (ZnОН)2SO4+H2SO4;
(ZnОН)2SO4+H2SO4;
в растворе соли избыток ионов Н+, среда кислая, рН7.
Гидролиз соли, образованной слабым основанием и слабой кислотой, протекает, как правило, до конца; в результате образуются слабое основание и слабая кислота:
|
Al2S3 |
Al(OH)3– слабое основание H2S– слабая кислота |
2Al3+ + 3S2- |
Гидролизу подвергаются катионы слабого основания и анионы слабой кислоты:
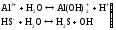 (Іступень)
(Іступень)
Образующиеся ионы Н+ и ОН- нейтрализуют друг друга, что вызывает смещение равновесия в сторону усиления гидролиза. Вследствие этого становится возможным протекание следующих ступеней гидролиза:
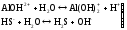 (II
ступень)
(II
ступень)
По указанной выше причине протекет и третья ступень гидролиза:
Al(OH) +H2O
= Al(OH)3
+ Н+
(III
ступень).
+H2O
= Al(OH)3
+ Н+
(III
ступень).
Суммарное ионно-молекулярное уравнение имеет вид:
2Al3+ + 3S2- + 6H2O = 2Al(OH)3 + H2S
или в молекулярном виде: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S.
Таким образом, сульфид алюминия гидролизуется в растворе полностью и необратимо с образованием нерастворимого гидроксида Al(OH)3 и слабой кислоты H2S. рН раствора близок к 7. Характер среды (слабокислая или слабощелочная) определяется константой диссоциации слабого основания или слабой кислоты по первой ступени.
При сливании водных растворов двух солей, имеющих разную природу, т.е. одна образована слабой кислотой и сильным основанием, а другая – слабым основанием и сильной кислотой, происходит совместный гидролиз этих солей. Одна соль гидролизует по аниону, а другая – по катиону. Образующиеся в результате гидролиза ионы ОН- и Н+ нейтрализуют друг друга, и равновесие каждой из ступеней гидролиза смещается вправо, т.е. гидролиз усиливается и в некоторых случаях идет до конца, например:
Al2(SO4)3 + 3Na2SO3 + 6H2O = 2Al(OH)3 + 3Н2SO3 + 3Na2SO4;
в ионно-молекулярной форме уравнение гидролиза имеет вид:
2Al3+
+ 3SО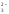 + 6H2O
= 2Al(OH)3
+ 3Н2SО3.
+ 6H2O
= 2Al(OH)3
+ 3Н2SО3.