ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2242
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Стандартный
водородный электрод
представляет собой стеклянный сосуд,
в который помещают платиновую пластинку,
покрытую платиновой чернью (рыхлой
пористой платиной с большой поверхностью
для сорбции газообразного водорода).
Сосуд заполняется раствором серной
кислоты с концентрацией ионов водорода
1 моль/л. Через сосуд пропускают
газообразный водород под давлением 1
атм (≈105
Па) при температуре 298К. Часть поглощенного
платиной водорода переходит в атомарное
состояние, поэтому в поверхностном слое
пластины устанавливается равновесие:
½(Н2)
![]() (Н), а на границе платины и раствора
серной кислоты – равновесие:
(Н), а на границе платины и раствора
серной кислоты – равновесие:
{Н+}
+ ē
![]() ½(Н2)
или 2{Н+}
+ 2ē
½(Н2)
или 2{Н+}
+ 2ē
![]() (Н2).
(Н2).
Схематически водородный электрод изображают следующим образом: Рt, Н2 / Н+
Потенциал водородного электрода при стандартных условиях (СН+ = 1 моль/л; РН2 = 1атм; Т = 298К) принят равным нулю: ЕºН+/Н2 = 0. Электродные потенциалы металлов, измеренные по отношению к стандартному водородному при стандартных условиях (С Меn+= 1моль/л; Т = 298К) называют стандартным и обозначают ЕºMen+/Me.
Величиной стандартного электродного или окислительно-восстановительного потенциала, измеренного по отношению к стандартному водородному электроду, можно характеризовать равновесие между любой окисленной и восстановленной формой при концентрации всех форм, участвующих в электродном равновесии, равной 1 моль/л и температуре 298К. Значения Еº для окислительно-восстановительных систем можно найти в справочниках, эти значения находятся в диапазоне от –3 до ≈+3В. Минимальное значение (-3,0 В) отвечает электродному равновесию Li+ + ē = Li, максимальное значение +2,87В характеризует электрохимическую систему F2 + 2ē = 2F-. Чем ниже значение Еº, тем более выражены восстановительные свойства восстановленных форм соответствующих окислительно-восстановительных систем. И наоборот, чем выше значение Еº, тем более выражены окислительные свойства окисленных форм соответствующих окислительно-восстановительных систем. Самым сильным восстановителем в водном растворе является Li, самым сильным окислителем F2. Сильные восстановители сопряжены в паре со слабыми окислителями (Li+), сильные окислители сопряжены в паре со слабыми восстановителями (F-). Условно можно принимать, что хорошим окислителям соответствуют потенциалы ≈ 1 – 0,5В.
Значения окислительно-восстановительных потенциалов Е процессов, протекающих в условиях, отличных от стандартных, зависят от концентраций окисленной и восстановленной форм, от температуры и определяются по уравнению Нернста:
RT ПСν (ок.ф.)
Е = Еº + ----- ln --------------- ,
nF ПСκ (восст.ф.)
где Е – потенциал системы при условиях, отличных от стандартных; Еº - стандартный окислительно-восстановительный потенциал окислительно-восстановительного процесса; R – универсальная газовая постоянная, равная 8,314 Дж/(моль·К); Т – температура, К; F – число Фарадея, равное ≈96500 Кл/моль; n – число молей эквивалентов электронов, участвующих в электрохимической реакции; ПСν (ок.ф.), ПСκ (восст.ф.) – произведение концентраций окисленной и восстановленной форм; ν, κ - их стехиометрические коэффициенты.
Если в уравнение Нернста подставить значения постоянных F, R, перейти к десятичному логарифму, Т = 298К, получим:
Е
= Еº +
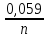 lg
lg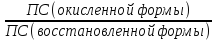 .
.
Например, для системы Co3+ + ē = Co2+
Е
= 1,84 +
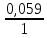 lg
lg
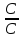 -
-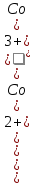 ---
.
---
.
Для системы Cu2+ + 2ē = Cu
Е
= 0,34 +
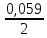 lg
С(Cu2+).
lg
С(Cu2+).
ПРИМЕР1. Рассчитать потенциал серебряного электрода, помещенного в 0,1М раствор нитрата серебра, при Т = 298К.
РЕШЕНИЕ. AgNO3 является сильным электролитом:
AgNO3 → Ag+ + NO3-.
C(Ag+) = Co·α·n = 0,1·1 1 = 0,1 (моль/л).
В 0,1М растворе AgNO3 концентрация ионов Ag+ = 0,1 моль/л.
Е
= 0,8 +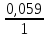 lg
0,1 = 0,8 – 0,059 = 0,741 (В).
lg
0,1 = 0,8 – 0,059 = 0,741 (В).
ПРИМЕР 2. Магниевую пластинку опустили в раствор соли, при этом электродный потенциал Е(Mg2+/Mg) оказался равным –2,41В. Вычислить концентрацию (моль/л) ионов магния в растворе.
РЕШЕНИЕ. Поскольку Е(Mg2+/Mg) = Еº(Mg2+/Mg) + 0,059/2 lgC(Mg2+),
[Е(Mg2+/Mg)
- Еº(Mg2+/Mg)]
=
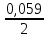 lgC(
Mg2+)
lgC(
Mg2+)
(-2,41+2,37)
=· lgC(
Mg2+)
lgC(
Mg2+)
C (Mg2+) = 0,044 моль/л.
ПРИМЕР 3. Вычислить потенциал водородного электрода в 0,1М растворе H2SO4.
РЕШЕНИЕ. H2SO4 является сильным электролитом:
H2SO4 → 2H+ + SO42-.
C(H+) = Co·α·n = 0,1 1 2 = 0,2 (моль/л).
Подставляем C(H+) в уравнение Нернста:
Е
(H+/H2)
= 0 +
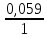 -lg
0,2 = – 0,041(В).
-lg
0,2 = – 0,041(В).
Используя значения стандартных электродных потенциалов, можно определить возможность и глубину протекания окислительно-восстановительных реакций. Чем более отрицательным является значение Еº, тем лучшим восстановителем является вещество и наоборот, чем более положительное значение Еº, тем лучшим окислителем является вещество. Например, из двух веществ – цинка и H2SO3 – более сильным восстановителем является Zn:
Zn2+ + 2ē = Zn; Еº = -0,76B;
SO42- + 4H+ + 2ē = H2SO3 + H2O; Еº = 0,17B.
Сопоставляя окислительные способности оксида марганца(IV) и перманганат-иона в кислой среде, можно сделать вывод, что ион MnO4- является более сильным окислителем, так как для соответствующего окислительно-восстановительного процесса значение Еº более положительно:
MnO2 + 4H+ + 2ē = Mn2+ + 2H2O; Еº = 1,23B;
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O; Еº = 1,51B.
Самопроизвольно протекающие реакции характеризуются отрицательной величиной изменения энергии Гиббса (∆Gº298). Величина ∆Gº298 для окислительно-восстановительных реаккций связана с разностью потенциалов двух окислительно-восстановительных пар уравнением:
∆Gº298 = -n·F·∆Eº298 (2),
где n – число молей эквивалентов электронов, участвующих в электрохимической реакции; F – число Фарадея; ∆Eº298 = Eºокислителя - Eºвосстановителя.
Поскольку термодинамически возможны процессы, для которых ∆Gº298 < 0, то для термодинамически возможных процессов ∆Eº298 > 0. Чем больше значение ∆Eº298, тем более глубоко протекает процесс.
ПРИМЕР 4. Определить направление окислительно-восстановительной реакции:
K2Cr2O7 + 6KI + 7 H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O.
Определить также ∆Gº298 протекающего процесса.
РЕШЕНИЕ. Для определения возможности осуществления ОВР необходимо сравнить окислительно-восстановительные потенциалы Eº соответствующих полуреакций окисления и восстановления:
Cr2O72- + 14H+ + 6ē = 2Cr3+ + 7H2O; Еº = 1,33B;
I2 + 2ē = 2I-; Еº = 0,54B.
Значения Eº показывают, что ион Cr2O72- является более сильным окислителем, чем I2. Следовательно, реакция будет протекать в прямом направлении. ∆Eº298 = Eºокисл. - Eºвосст. = 1,33 – 0,54 = 0,79(В).
∆Gº298 = -nF∆Eº298 = -6·96500·0,79 = -457410Дж = -457,41кДж.
Величина ∆Gº298 связана с константой химического равновесия соотношением:
∆Gº298 = -R·T·lnKc или при 298К ∆Gº298 = -R·298·lnKc,298 (3).
Приравнивая правые части уравнений (2) и (3), получим:
-n·F·∆Eº298 = -R·298·lnKc,298.
Отсюда
lgKс
=
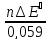 или
Кс
=
или
Кс
=
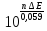 .
.
ПРИМЕР 5. Для окислительно-восстановительной реакции
KMnO4 + Al + H2SO4 →… определить ∆Gº298 и значение константы Кс при 298К.
РЕШЕНИЕ. Запишем уравнение реакции:
6KMnO4 + 10Al + 24H2SO4 = 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O.
Полуреакции окисления, восстановления и их значения Eº:
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O; Еº = 1,51B;
Al - 3ē = Al3+; Еº = -1,66B.
∆Eº298 = 1,51 – (-1,66) = 3,17(B).
∆Gº298 = -nF∆Eº298 = -15·96500·3,17 = -4588575Дж = -4588,6кДж.
n·∆Eº/0,059
Кс = 10 = 1015· 3,17/0,059 = 8,55·10805.
Значение Кс очень велико, что свидетельствует о практической необратимости прямой реакции.
Гальванические элементы
Гальваническим элементом называется электрохимическая система, производящая электрическую энергию за счет протекания в ней окислительно-восстановительной реакции. Наиболее распространенными являются гальванические элементы, состоящие из двух электродов с различными потенциалами. Рассмотрим реакцию:
Zn + CuSO4 = ZnSO4 + Cu
Сущность этой реакции вытеснения сводится к восстановлению одним металлом иона второго. Например, в ряду металлов Zn, Fe, Cu, Ag каждый предыдущий вытесняет последующий из его солей, тогда как обратное вытеснение не наблюдается.
Процесс взаимодействия цинка с ионом меди по приведенной выше схеме можно разбить на две полуреакции:
Zn – 2e = Zn2+
Cu2+ + 2e = Cu
Очевидно, что если бы удалось осуществить передачу электронов не непосредственно, а через металлический проводник, то по нему потек бы от цинка к меди поток электронов, т.е. электрический ток. На рисунке 1 показана схема гальванического элемента, т.е. установки, делающей возможной такую передачу электронов по проводу. В гальваническом элементе происходит непосредственное преобразование энергии химической реакции в электрическую энергию.
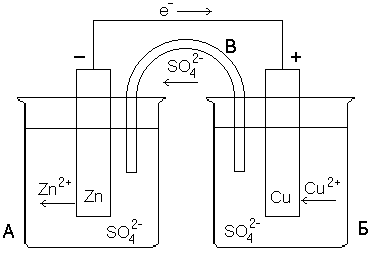
Рисунок 1 – Конструкция медно-цинкового гальванического элемента (элемент Даниэля-Якоби)
Сосуд А заполнен раствором ZnSO4, сосуд Б – раствором CuSO4. В первый из них опущена цинковая пластинка, во второй – медная. Растворы либо разделены пористой полупроницаемой перегородкой (пропускает только ионы), либо соединяются солевым мостиком B, который представляет собой стеклянную трубку, заполненную раствором сильного электролита (обычно KCl или NH4NO3). Если соединить обе пластинки проводом, то по нему в указанном стрелкой направлении начнут перемещаться электроны (потечет электрический ток). Трубка В обеспечивает замкнутость цепи, по ней перемещаются ионы SO42–. Электрод, на котором происходит процесс восстановления (на рисунке 1 – медный) называется катодом, а электрод, на котором осуществляется окисление (в рассмотренном примере – цинковый) – анодом. В электротехнике принята противоположная система обозначений электродов: катодом называют отрицательный полюс источника тока, т.е. электрод, передающий электроны во внешнюю цепь (в данном случае цинковый).