ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2235
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Особенности протекания катодных процессов можно представить в виде таблицы 1:
|
Катионыактивныхметаллов |
Катионыменее активныхметаллов |
Катионынеактивныхметаллов |
|
Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ |
Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ |
Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
|
Тяжело
разряжаются (только из расплавов), в
водном растворе электролизу подвергается
вода с выделением водорода: 2H2O
+2ē |
В водном растворе восстанавливаются металл и вода: Меn+ +nē = Ме 2H2O
+2ē
|
Легко
разряжаются и восстанавливается
только металл
Меn++nē |
Среди процессов, протекание которых возможно на аноде (анодом в электрохимии называется электрод, на котором протекает полуреакция окисления), в первую очередь осуществляется тот, электродный потенциал которого имеет наиболее низкое значение. Процессы, происходящие на аноде, зависят как от электролита, так и от материала, из которого изготовлен анод. Аноды подразделяют на нерастворимые (инертные) и растворимые. Инертные электроды изготавливают из неметаллов, проводящих электрический ток (графит), из инертных металлов (Pt, Au, Ta). Нерастворимые аноды не окисляются при электролизе. При электролизе водного раствора на аноде могут окисляться:
1) Анионы электролита;
2) молекулы воды в нейтральной и кислой среде: 2H2O – 4e = 4H+ + O2 (E=1,23В);
3) ионы OH– в щелочной среде: 4OH– – 4e = 2H2O + O2 (E=0,40В);
4) материал анода (в случае растворимого электрода, например, медного).
Окисление анионов кислородсодержащих кислот (SO42–, CO32–, PO43–, NO3– и т.п.) в водном растворе невозможно, т.к. полуреакции окисления воды или ионов OH– с выделением кислорода характеризуются более низкими значениями потенциалов. При электролизе водных растворов галогенидов на аноде происходит окисление галогенид-ионов (кроме F–) с образованием свободных галогенов. Из-за кислородного перенапряжения при электролизе водных из растворов хлоридов на аноде выделяется не кислород, а хлор, хотя его стандартный электродный потенциал (1,36В) имеет большее значение по сравнению с кислородным Eº (O2+4H+/2H2O)=1,23В.
Электролиз растворов щелочей, фтористоводородной кислоты и ее солей происходит с выделением кислорода.
Растворимые аноды при электролизе могут окисляться сами, растворяясь при этом. Такой процесс используется для очистки металлов и называется рафинированием. Растворимые аноды изготавливают из меди, цинка, кадмия, никеля и др. металлов.
Особенности протекания анодных процессов можно представить в виде таблицы 2:
|
Анионы кислородсодержащих кислот |
Гидроксид-ионы; анионы бескислородных кислот (кроме F-) |
|
PO43-, CO32-, SO42-, NO3-, NO2-, ClO4- |
OH-,Cl-,Br-,I-,S2- |
|
Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода:
2H2O
– 4e
|
Легко разряжаются 2Cl-– 2e =Cl2 |
Законы электролиза
Количественные характеристики электролиза выражаются двумя законами Фарадея:
1) Масса вещества, выделяющегося на электроде, прямо пропорциональна количеству электричества, прошедшего через электролит.
2) При электролизе различных химических соединений одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные их электрохимическим эквивалентам.
Эти два закона можно объединить в одном уравнении:
![]() ,
,
где m – масса выделяющегося вещества, г;
n – количество электронов, переносимых в электродном процессе;
F – число Фарадея (F=96485 Кл/моль)
I – сила тока, А;
t – время, с;
M – молярная масса выделяющегося вещества, г/моль.
Величина
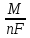 называется электрохимическим эквивалентом
вещества.
называется электрохимическим эквивалентом
вещества.
Вследствие
параллельных побочных процессов масса
вещества, получаемого при электролизе,
оказывается часто меньше той, которая
соответствует количеству прошедшего
электричества. Отношение массы вещества,
реально выделенного на электроде, к
теоретической и умноженное на 100%,
называют выходом по току: ![]() .
.
Примеры электролиза Расплавы
Пример 1. Составить уравнения процессов, протекающих на катоде и аноде, определить образующиеся продукты электролиза расплава сульфата натрия.
Решение. Соль активного металла и кислородосодержащей кислоты в расплаве также диссоуиирует:
Na2SO4↔2Na++SO42-
K(-): 2Na+ +2e =2Na0
A(+): 2SO42- -4e =2SO3+O2
Суммарный
процесс:
2Na2SO4
 →
4Na + 2SO3
+ O2
→
4Na + 2SO3
+ O2
Пример 2. Составить уравнения процессов, протекающих на катоде и аноде, определить образующиеся продукты электролиза расплава щелочи
Решение: NaOH ↔ Na+ + OH-
K(-): Na+ +1e =Na0
A(+): 4OH- ‑4e =2H2O + O2
Суммарный
процесс: 4NaOH
 →
4Na
+ 2H2O
+ O2
→
4Na
+ 2H2O
+ O2
Растворы
Пример 1. Через водный раствор сульфата натрия в течение некоторого времени пропускали постоянный ток. Составить уравнения процессов, протекающих на катоде и аноде, определить образующиеся продукты электролиза.
Решение . Na2SO4 в растворе диссоциирует:
Na2SO4 → 2Na+ + SO42-.
В растворе находятся ионы Na+ и SO42-, а также молекулы воды. При прохождении тока через раствор катионы Na+ движутся к катоду, а анионы SO42- - к аноду. Для восстановления ионов Na+ к катоду надо приложить потенциал, равный –2,71В, а для восстановления молекул воды –0,828В. Поскольку восстановление молекул воды требует большей величины потенциала, то на катоде будут разряжаться молекулы воды.
К аноду перемещаются анионы SO42-, однако разрядка их на электроде не происходит, так как электродный потенциал, характеризующий систему 2SO42- - 2ē = S2O82-; Еº = +2,01B, значительно выше электродного потенциала окисления воды (+1,23В). Поэтому энергетически более выгодным является электрохимическое окисление воды с выделением кислорода. Ионы соли не участвуют в протекающем окислительно-восстановительном процессе. Процесс электролиза выражается схемой:
Катод ─ 2H2O + 2ē = H2 + 2OH-; -процесс восстановления
Анод + 2H2O –4ē = О2 + 4Н+; - процесс окисления
6H2O
 →
2H2
+ 4OH-
+О2
+ 4Н+;
– суммарное уравнение в ионном виде.
→
2H2
+ 4OH-
+О2
+ 4Н+;
– суммарное уравнение в ионном виде.
Продуктом электролиза у катода является водород, который выделяется, и ионы OH-, образующие NaOH с ионами Na+. Продуктом электролиза у анода является кислород, который выделяется, и ионы Н+, образующие с ионами SO42- серную кислоту. Если растворы катодного и анодного пространства перемешивают, то образующиеся в результате электролиза щелочь и кислота нейтрализуются и дают вновь Na2SO4. В результате электролиз раствора Na2SO4 сводится к разложению воды электрическим током:
2H2O
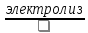 →
2H2
+ О2.
→
2H2
+ О2.
Пример 2. Рассмотреть электролиз раствора хлорида меди(II) с инертными электродами.
Решение . Хлорид меди в растворе диссоциирует:
CuCl2 → Cu2+ + 2Cl-.
На катоде в соответствии с табл.1 восстанавливаются катионы меди, на аноде окисляются хлорид-ионы (табл.2):
Катод ─ Cu2+ + 2ē = Cu; ‑процесс восстановления
Анод + 2Cl- –2ē = Сl2; ‑ процесс окисления
CuCl2
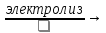 Cu
+Cl2;
– суммарное уравнение электролиза
Cu
+Cl2;
– суммарное уравнение электролиза
Пример 3 .Соль активного металла и бескислородной кислоты
NaCl → Na+ + Cl-
K«катод»(-): 2H2O + 2e = H2 + 2OH-
A«анод»(+): Cl- - 1e = Cl0; Cl0+Cl0=Cl2
Суммарный
процесс: 2NaCl
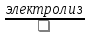 → 2H2
+ Cl2
→ 2H2
+ Cl2
Прмер 5. Раствор гидроксида натрия:
NaOH → Na+ + OH-
K(-): 2H2O + 2e = H2 + 2OH-
A(+): 4OH- - 4e = 2H2O + O2
Вывод:
2H2O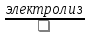 → 2H2
+ O2
→ 2H2
+ O2
Задача. Рассмотрим расчёт напряжения разложения на примере электролиза водного раствора хлорида никеля (II).
РЕШЕНИЕ. В водном растворе хлорид никеля (II) диссоциирует по схеме
NiCl2 = Ni2+ + 2Cl–.
Положительно заряженные ионы никеля подходят к катоду, на котором происходит их восстановление.
Катод (–) Ni2+ + 2е– = Ni.
На аноде окисляются ионы Cl–.
Анод (+) 2Cl– – 2е– = Cl2
Ni2+
+ 2Cl–
 =
Ni + Cl2
=
Ni + Cl2
суммарный процесс при электролизе в ионно-молекулярной форме .
Выделение Ni на катоде и Cl2 на аноде приводит к возникновению хлорно-никелевого гальванического элемента:
– NiNi2+ Cl-Cl2 +
Равновесие на электроде, покрытом Ni:
Ni2+
+ 2е– = Ni 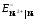 =
–0,25 В.
=
–0,25 В.
Равновесие на хлорном электроде:
Cl2
+ 2е– = 2Cl–
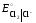 =
1,36 В.
=
1,36 В.
Если принять, что концентрация Ni2+ и Cl– стандартные (1моль/л), то при установлении равновесия на каждом из электродов возникнет скачок потенциала, равный стандартному электродному потенциалу (табличное значение).
Никелевый электрод в образовавшемся гальваническом элементе будет восстановителем, хлорный электрод выступит в роли окислителя.
Ni – 2е– = Ni2+
Cl2 + 2е– = 2Cl–
Ni + Cl2 = Ni2+ + 2Cl–.
Суммарный
процесс Ni + Cl2
= Ni2+
+ 2Cl–
характеризуется разностью потенциалов
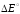 =
=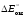 –
–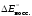 = 1,36 + 0,25 = 1,61 (В). Разность потенциалов
возникшего гальванического элемента
и есть
= 1,36 + 0,25 = 1,61 (В). Разность потенциалов
возникшего гальванического элемента
и есть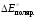 .
Процессы, протекающие на электродах
(гальванический элемент), препятствуют
протеканию тока от внешнего источника.
Поэтому приложенное извне напряжение
для осуществления электролиза не должно
быть меньше
.
Процессы, протекающие на электродах
(гальванический элемент), препятствуют
протеканию тока от внешнего источника.
Поэтому приложенное извне напряжение
для осуществления электролиза не должно
быть меньше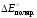 .
.
 →
H2+ 2OH-
→
H2+ 2OH- H2
+ 2OH-
H2
+ 2OH- →
Ме
→
Ме →
4H+
+ O2
→
4H+
+ O2