ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.08.2024
Просмотров: 2246
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и законы химии Атомно - молекулярное учение.
Закон сохранения массы веществ
Составление химических уравнений
Расчеты по химическим уравнениям
Закон Авогадро и молярный объем газа
Основные классы неорганических
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Графическое изображение формул
Химическое равновесие. Константа химического равновесия
Энергия Гиббса направленность химических процессов
Примеры термодинамических расчетов
Химическая кинетика. Скорость химической реакции
Молекулярность элементарных реакций
Смещение химического равновесия
3 Влияние температуры на положение равновесия
Основные характеристики растворов
Растворимость газов в жидкостях
Взаимная растворимость жидкостей
Растворимость твердых веществ в жидкостях
1. Давление насыщенного пара разбавленных растворов
2. Давление пара идеальных и реальных растворов
3. Температура кристаллизации разбавленных растворов
4. Температура кипения разбавленных растворов
5. Осмотическое давление разбавленных растворов
6. Понятие активности растворенного вещества
Слабые электролиты. Константа диссоциации
Количественные характеристики процесса гидролиза соли.
Направленность реакций в растворах электролитов
Протонная теория Брёнстеда-Лоури
Коррозия металлов и методы защиты металлов от коррозии
Волновое уравнение. Квантовомеханическое объяснение строения атома
Электронная структура атомов и периодическая система элементов
Структура периодической системы элементов д.И. Менделеева.
Периодичность свойств химических элементов и их соединений
Ковалентная связь. Метод валентных связей
Способы образования ковалентной связи
Гибридизация атомных орбиталей
Квантовомеханические теории строения комплексных соединений
2. Гибридизация орбиталей и структура комплексов
Энергия расходуется человеческим организмом главным образом для осуществления следующих видов деятельности:
Химических превращениях в организме (метаболизм)
Для поддержания определенной температуры тела
Для выполнения мышечной работы. Расход энергии, кДж/мин: сидение -6, стояние – 10, ходьба – 16, бег – 40, метание копья и другие атлетические виды спорта - намного более 50.
Термохимические уравнения. Раздел химии, изучающий тепловые эффекты химических реакций и фазовых превращений, называется термохимией.
Уравнения процессов, в которых указаны тепловые эффекты, называются термохимическими. Тепловой эффект записывается либо непосредственно в уравнении реакции, например:
(N2 ) + 3(Н2) = 2(NНз) + 92 кДж
Или (N2 ) + 3(Н2) = 2(NНз), ΔНо298 = - 92 кДж
Чтобы отнести энтальпию реакции к одному молю какого-либо вещества, термохимические уравнения иногда имеют дробные коэффициенты:
2 Al + 3/2 O2 = Al2O3, ΔНо298 = - 1675,8 кДж
В некоторых случаях тепловой эффект относят к 1 моль какого-либо вещества, например: ΔНо298 = - 1675,8 кДж/моль.
В термохимических уравнениях записываются также агрегатные состояния или модификации исходных веществ и продуктов реакции:
(СО2)
+ [Cграфит] = 2(СО);Н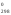 = 172,47 кДж.
= 172,47 кДж.
Термохимические расчеты основаны на законе Гесса: тепловой эффект реакции при постоянных температуре и давлении зависит только от природы и состояния исходных и конечных веществ и не зависит от числа и характера промежуточных стадий. Иными словами, если химический процесс можно осуществить несколькими путями, то изменение энтальпии суммарного процесса будет равно сумме изменений энтальпий отдельных стадий (закон аддитивности теплот реакций):
ΔНо1
Сграфит
+ О2
СО2
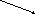
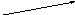
ΔНо2 ΔНо3
СО + ½ О2
ΔНо1 = ΔНо2 + ΔНо3
Из закона Гесса следует, что термохимические уравнения можно складывать, вычитать, умножать на численные множители.
Задача. Вычислить теплоту образования СО, если известны тепловые эффекты реакций:
Сграфит
+ О2
→ СО2
Н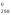 1
= -393,5 кДж/моль
1
= -393,5 кДж/моль
СО
+ ½ О2
→ СО2
Н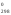 2=
-283,0 кДж/моль
2=
-283,0 кДж/моль
Сграфит
+ ½ О2
→ СО
Н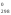 3
= -?
3
= -?
Последнее
уравнение получается, если из первого
вычесть второе. Следовательно
Н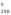 3 =
Н
3 =
Н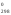 1
- Н
1
- Н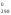 2
= -110,5 кДж/моль.
2
= -110,5 кДж/моль.
Обычно
в термохимических расчетах применяют
первое 1-е
следствие
из закона Гесса:
тепловой
эффект реакции (Н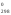 )
равен сумме стандартных теплот образования
(Н
)
равен сумме стандартных теплот образования
(Н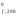 )
продуктов реакции за вычетом суммы
стандартных теплот образования исходных
веществ с учетом стехиометрических
коэффициентов:
)
продуктов реакции за вычетом суммы
стандартных теплот образования исходных
веществ с учетом стехиометрических
коэффициентов:
Н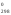 =
=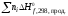 –
–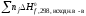 .
.
Обозначения:Н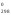 (Н
(Н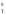 )
–стандартное
изменение энтальпии в реакции (тепловой
эффект реакции).Н
)
–стандартное
изменение энтальпии в реакции (тепловой
эффект реакции).Н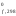 – стандартная
теплота (энтальпия) образования 1 моля
вещества из простых веществ.Н
– стандартная
теплота (энтальпия) образования 1 моля
вещества из простых веществ.Н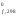 –изменение
энтальпии в процессе образования 1 моля
вещества из простых веществ при условии,
что все участники реакции находятся в
стандартных состояниях. ВеличиныН
–изменение
энтальпии в процессе образования 1 моля
вещества из простых веществ при условии,
что все участники реакции находятся в
стандартных состояниях. ВеличиныН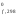 для
различных веществ приведены в справочной
литературе. Стандартные энтальпии
образования простых веществ приняты
равными нулю: Н
для
различных веществ приведены в справочной
литературе. Стандартные энтальпии
образования простых веществ приняты
равными нулю: Н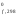 (простых веществ) = 0.
(простых веществ) = 0.
Размерность
Н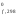 – кДж/моль;Н
– кДж/моль;Н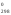 –
кДж.
–
кДж.
При вычислении тепловых эффектов (изменения стандартных энтальпий) различных процессов необходимо:
записать соответствующий процесс, указав агрегатные состояния веществ, участвующих в реакции;
расставить стехиометрические коэффициенты;
выписать из справочника значения стандартных энтальпий образования Н
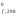 всех участвующих в реакции веществ в
соответствующих агрегатных состояниях;
всех участвующих в реакции веществ в
соответствующих агрегатных состояниях;используя следствие из закона Гесса, рассчитать тепловой эффект (Н
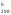 )
процесса. Стехиометрические коэффициенты
необходимо учитывать, так как энтальпия
является экстенсивной величиной.
)
процесса. Стехиометрические коэффициенты
необходимо учитывать, так как энтальпия
является экстенсивной величиной.
Задача 1. Рассчитать тепловой эффект (изменение энтальпии) реакции 4HCl+O2= 2Cl2+ 2H2Oв стандартных условиях.
Решение. Записываем уравнение реакции со стехиометрическими коэффициентами, обозначив агрегатные состояния веществ. Под формулой каждого из веществ выписываем из справочника значения стандартных энтальпий образования:
4(HCl) + (O2) = 2(Cl2) + 2(H2O)
Н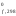 ,
-92,4 0 0 –241,98 кДж/моль.
,
-92,4 0 0 –241,98 кДж/моль.
Используя следствие из закона Гесса, рассчитываем тепловой эффект реакции:
Н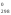 = 2Н
= 2Н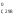 (H2O)
+ 2Н
(H2O)
+ 2Н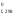 (Cl2)
– 4Н
(Cl2)
– 4Н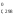 (HCl)
– Н
(HCl)
– Н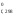 (O2)
= = 2
(–241,98) + 2
0 – 4(–92,4) – 0 = –114,36 кДж.
(O2)
= = 2
(–241,98) + 2
0 – 4(–92,4) – 0 = –114,36 кДж.
Рассматриваемый
процесс является экзотермическим (Н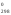 < 0).
< 0).
Задача 2. Рассчитать тепловой эффект процесса испарения воды:
Решение.{H2O} = (H2O)
H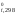 ,–285,84
–241,98 кДж/моль;
,–285,84
–241,98 кДж/моль;
H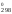 = (–241,98) – (–285,84) = 43,86 кДж.
= (–241,98) – (–285,84) = 43,86 кДж.
Процесс является эндотормическим.
Расчет изменения энтальпии процессов, протекающих в растворах
Тепловые эффекты реакций, протекающих в растворах, рассчитывают, используя сокращенные ионно-молекулярные уравнения соответствующих процессов. При расчете изменения энтальпий химических реакций, протекающих в растворах, используют стандартные энтальпии образования ионов - для диссоциирующих в воде соединений и стандартные энтальпии образования соединений - для тех веществ, которые не подвергаются диссоциации .
Стандартные
теплоты образования ионов
– величины относительные, так как
условно принято за ноль значение
стандартной энтальпии образования 1
моля иона водорода в 1 дм3
водного раствора в стандартных условиях
(давление 1 атм (101,32 кПа) и температура
298 К ). Стандартные энтальпии образования
других ионов определены относительно
стандартной энтальпии образования иона
водорода в растворе. Значения
H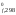 ионов также приведены в справочной
литературе.
ионов также приведены в справочной
литературе.
Задача 3. Рассчитать тепловой эффект реакции нейтрализации 1 моль соляной кислоты гидроксидом калия в стандартных условиях.
{HCl} + {KOH} = {KCl} + {H2O}
{H+} + {ОH-} → {H2O},
H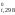 ,
кДж/моль 0 -230,19 –285,84 ;
,
кДж/моль 0 -230,19 –285,84 ;
ΔНо298 = -55,65кДж/моль
К процессам с участием органических веществ применимо 2-е следствие из закона Гесса: Тепловой эффект реакции равен сумме стандартных теплот сгорания исходных веществ с учетом стехиометрических коэффициентов за вычетом суммы стандартных теплот сгорания продуктов реакции с учетом стехиометрических коэффециентов.
Н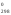 =
=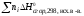 –
–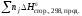 .
.
Большое значение тепловые эффекты сгорания имеют для определения калорийности пищи и теплотворной способности горючих веществ. Теплотворная способность – это тепловой эффект сгорания 1 кг твердого и жидкого веществ или единицы объема газообазного.
В ряде случаев для определения теплового эффекта можно использовать как 1-е, так и 2-е следствия из закона Гесса.
Химическое равновесие. Константа химического равновесия
Многие химические реакции являются обратимыми, т.е. могут одновременно протекать в обоих направлениях – прямом и обратном. Если проводить обратимую реакцию в закрытой системе, то через некоторое время система придет в состояние химического равновесия – концентрации всех реагирующих веществ перестанут изменяться во времени. Необходимо отметить, что достижение системой состояния равновесия не означает прекращения процесса; химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое равновесие является подвижным – всякое бесконечно малое внешнее воздействие на равновесную систему вызывает бесконечно малое изменение состояния системы; по прекращении внешнего воздействия система возвращается в исходное состояние. Ещё одним важным свойством химического равновесия является то, что система может самопроизвольно прийти в состояние равновесия с двух противоположных сторон. Иначе говоря, любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда связан с необходимостью затраты работы извне
Химически обратимые реакции первоначально протекают в одном направлении за счет взаимодействия между собой исходных веществ. По мере накопления продуктов реакции они начинают взаимодействовать между собой с образованием исходных веществ.
Рассмотрим обратимую реакцию, в которой порядок реакции по каждому из веществ совпадает со стехиометрическими коэффициентами.
а(A) + b(B) = c(C) + d(D)
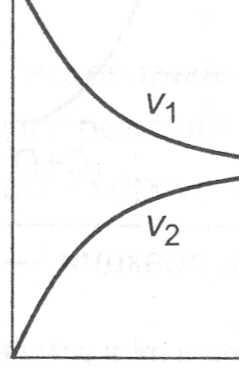
Время
Графическая зависимость скоростей прямой (V1) и обратной (V2) реакций обратимого химического процесса от времени
В результате в системе устанавливается химическое равновесие, и концентрации исходных и конечных веществ перестают изменяться. Неизменность концентраций веществ во времени может наблюдаться также в случае очень медленно протекающих реакций. Но такое состояние не является истинным химическим равновесием. Признаки истинного химического равновесия:
состояние системы остается неизменным во времени при отсутствии внешних воздействий;
состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были;
состояние системы не зависит от того, с какой стороны она подходит к равновесию.