ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1132
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
1.4. Правила взятия, консервирования и транспортировки патологического материала
При отборе и обработке патологического материала для пересылки в лабораторию необходимо придерживаться следующих правил:
- учитывать патогенез болезни и тропизм возбудителя;
- использовать стерильные инструменты и посуду;
- доставлять его в максимально сжатые сроки;
- отбирать материал до начала лечения антимикробными препаратами.
В лабораторию могут быть направлены: а) пробы материала от больных и подозрительных в заболевании животных: кровь, сыворотка крови, кал, моча, молоко, экссудаты, гной, соскобы с кожи и др.; б) патологический материал от трупов животных: абортированный плод, трубчатая кость, лимфоузлы, мышцы, головной мозг, спинной мозг, паренхиматозные органы и др.; в) пробы из объектов внешней среды: воды, почвы, фуража; клещи, насекомые, грызуны и др.
Трупы мелких животных, а также поросят, ягнят, телят лучше посылать целиком во влагонепроницаемой таре.
Трубчатые кости, посылаемые на исследование, должны быть целыми, с неповрежденными концами, обернутыми в марлю или полотно, смоченное дезинфицирующей жидкостью (5%-ным раствором карболовой кислоты).
Перед отбором молока сосок вымени дезинфицируют 70°-ным спиртом, сдаивают 100 – 150 мл молока в банку с дезраствором, а последующие порции в количестве 30 мл – в стерильные сосуды.
Кровь берут в пробирки или колбы из яремной вены с соблюдением стерильности. Кал берут из прямой кишки стеклянной трубочкой с оплавленными краями, один конец трубочки закрывают ватно-марлевой пробкой. После взятия кала трубку опускают в пробирку с физиологическим раствором.
Мочу у животных берут с помощью катетера.
Экссудат берут пастеровскими пипетками или стерильными тампонами.
Соскобы со слизистых оболочек и кожи берут стерильным скальпелем в стерильную посуду с пробкой. Абортированный плод первой половины беременности направляют целиком. От плодов второй половины беременности берут паренхиматозные органы или плод направляют целиком.
От трупов обязательно берут сердце целиком с кровью.
Кусочки селезенки, почек, печени с желчным пузырем берут, используя стерильные инструменты и стерильную посуду.
Желудок и кишечник перевязывают лигатурой с обоих концов и помещают в отдельную посуду.
Мозг для исследования направляют целиком.
При упаковке патологического материала необходимо исключить загрязнение его посторонней микрофлорой из внешней среды.
Патологический материал должен быть доставлен в лабораторию в течение первых 24 часов после его взятия. Если эти условия трудно выполнить, то материал необходимо консервировать 30%-ным водным раствором глицерина или 10%-ным водным раствором хлористого натрия или раствором глицерина с хлористым натрием (глицерина – 250,0 мл; хлористого натрия – 5,0 г; дистиллированной воды – 750,0 мл).
Доставка патологического материала в лабораторию осуществляется нарочным. На взятый патологический материал, направляемый в лабораторию, составляется сопроводительное письмо по следующей форме:
Сопроводительное письмо на патологический материал
В ___________________________________ветеринарную лабораторию
(республиканскую, областную, районную)
Адрес _______________________________________________
При этом для бактериологического, гистологического, токсикологического, микотоксикологического, серологического исследованиям направляется материал (перечислить с нумерацией весь материал, например: 1 – сердце с кровью, 2 – кусочек печени с желчным пузырем, 3 – трубчатая кость и т.д.) от________________________________________________________________
__________________________________________________________________ (указать вид животного, пол, возраст, инвентарный номер, группу, владельца).
Дата заболевания (животного) ____________, падежа________________
Клиническая картина__________________________________________
____________________________________________________________________________________________________________________________________
Данные патологоанатомического вскрытия________________________
____________________________________________________________________________________________________________________________________
Эпизоотологические данные____________________________________
____________________________________________________________________________________________________________________________________
Предположительный диагноз____________________________________
Прошу_________исследовать_________на_________________________
Просим исключить заболевание__________________________________
Дата___________________ Должность_________________________________
Подпись________________________________________(Фамилия полностью)
Обратный адрес____________________________________________________
Задания для самостоятельной работы
Ознакомиться с кафедральной лабораторией, оборудованием и аппаратурой.
Подготовить посуду, инструменты и материалы для отбора проб патологического материала, включая консерванты.
Провести отбор и упаковку патологического материала.
Под руководством преподавателя составить сопроводительное письмо на патологический материал.
Вопросы для самоподготовки и контроля знаний
Назначение, структура ветеринарных лабораторий и ее оборудование, аппаратура.
Какие правила по технике безопасности необходимо соблюдать при работе в лаборатории?
Назовите методы исследований, применяемые при лабораторной микробиологической диагностике инфекционных болезней животных.
В чем заключаются правила взятия, консервирования и транспортировки патологического материала для исследования?
А. МИКРОСКОПИЧЕСКИЕ МЕТОДЫ
ИССЛЕДОВАНИЙ
ТЕМА 2. Устройство микроскопа и правила работы с ним (2.1). Виды микроскопии (2.2)
ЦЕЛЬ ЗАНЯТИЯ. Изучить устройство микроскопа и освоить правила работы с ним. Дать представление о видах и назначении различных методов микроскопии.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Микроскопы и набор готовых окрашенных препаратов-мазков. Иммерсионное масло, осветители, таблицы, схемы, диаграммы.
Микроорганизмы представляют собой мельчайшие живые организмы, невидимые невооруженным глазом. Размеры их колеблются в широких пределах – от 0,2 до 10 микрометров (мкм) и более (1 мкм составляет 1/1000 долю миллиметра).
Форму и другие особенности бактериальных клеток изучают при помощи микроскопии чаще всего в убитом окрашенном состоянии, реже – в живом в неокрашенном виде.
2.1. Устройство оптического микроскопа.
Микроскопы позволяют исследовать объекты в проходящем свете. Такие микроскопы состоят из механической и оптической частей (рис.1).
Механическая часть включает штатив (1) с предметным столиком (2) и тубус (16). Предметный столик с помощью винтов может перемещаться в горизонтальной плоскости (3). Он имеет две клеммы, фиксирующие препарат(4). Верхняя часть штатива – тубусодержатель – может перемещаться с помощью макрометрического винта (12) и микрометрического винта (13), предназначенных соответственно для грубой и точной фокусировки препарата. Микрометрический винт является одной из наиболее хрупких частей микроскопа и обращаться с ним нужно особенно осторожно. Полный поворот его передвигает тубус на 0,1 мм.
В верхней части тубусодержателя находится вращающийся вокруг своей оси револьвер (14), в отверстия которого ввинчены объективы (15). В верхний конец тубуса вставляется окуляр (18).
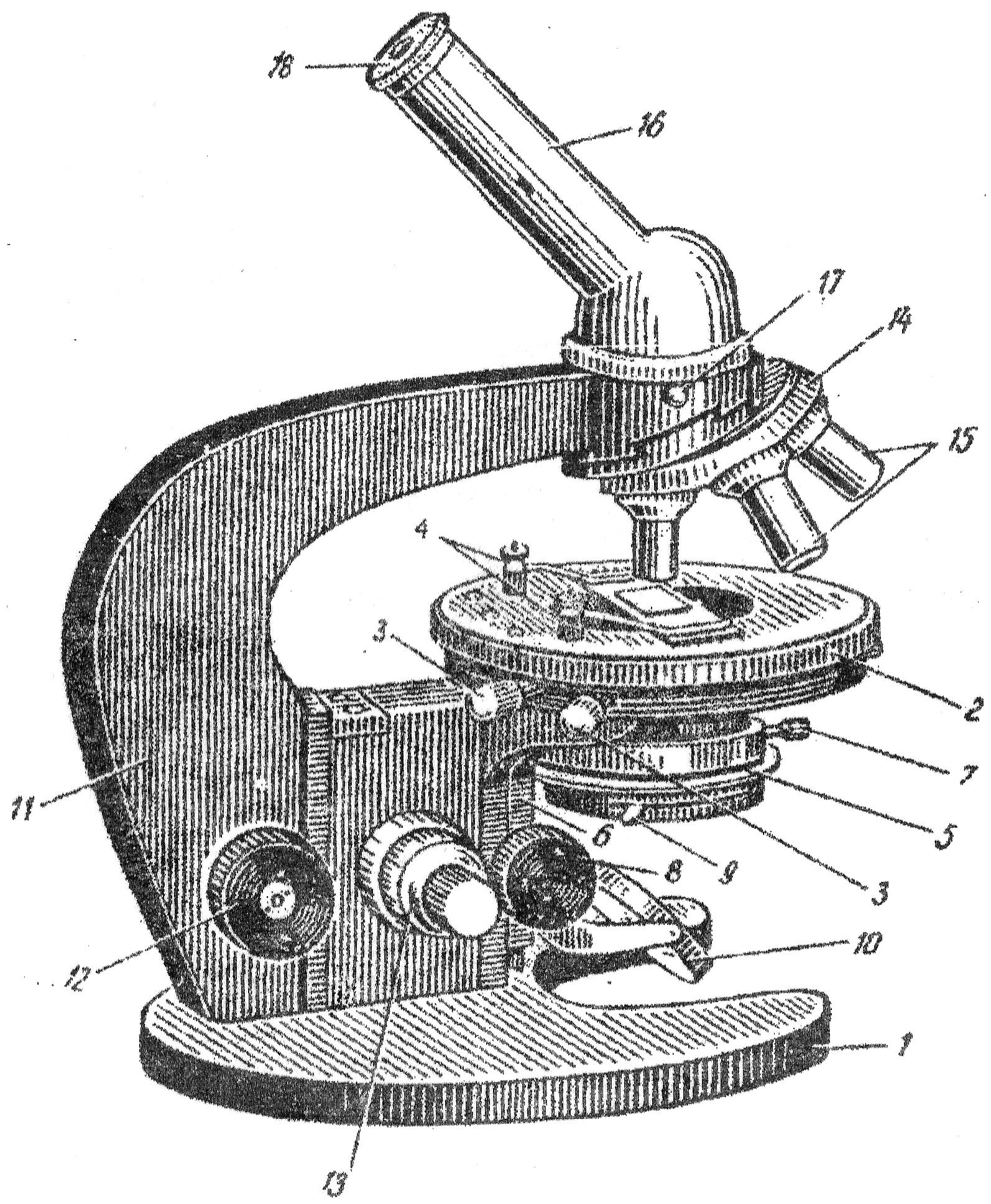
Рис.1 Микроскоп МБР-1: 1 – основание микроскопа; 2 – предметный столик; 3 – винты для перемещения предметного столика; 4 – клеммы, фиксирующие препарат; 5 – конденсор; 6 – кронштейн конденсора; 7 – винт, укрепляющий конденсор в гильзе; 8 – рукоятка перемещения конденсора; 9 – рукоятка ирисовой диафрагмы конденсора; 10 – зеркало; 11 – тубусодержатель; 12 – макрометрический винт; 13 – микрометрический винт; 14 – револьверное устройство для объективов; 15 – объективы; 16 – наклонный тубус; 17 – винт для крепления тубуса; 18 – окуляр.
Оптическая часть состоит из объективов, окуляров и осветительного аппарата.
Окуляр вставляется в верхний конец тубуса. Он состоит из двух линз в оправе. На окуляре имеются цифровые обозначения, показывающие степень увеличения изображения в 7, 10, 15 раз.
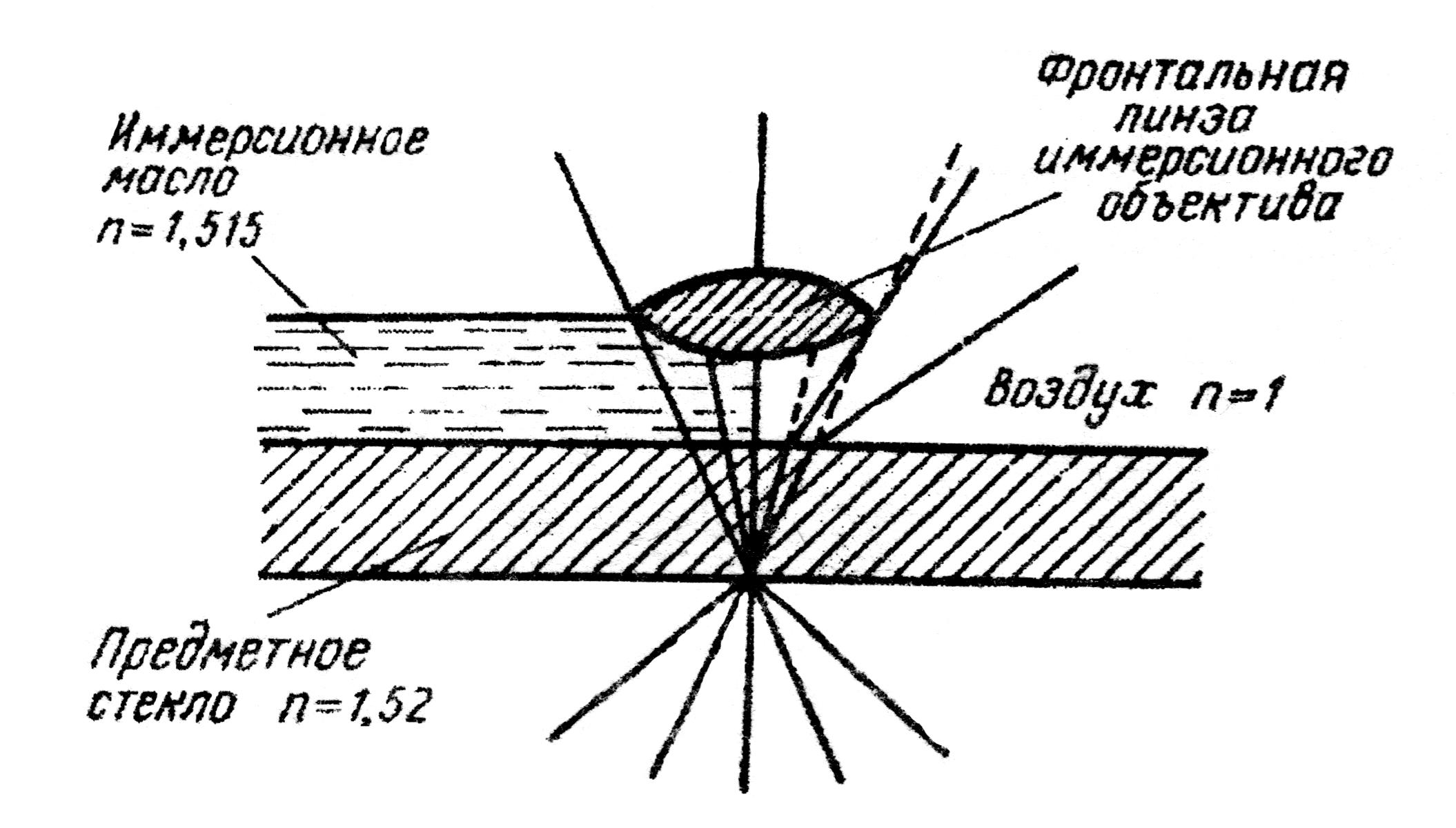
Рис. 2. Ход лучей в иммерсионном объективе
Объектив представляет собой систему оптических линз. На объективах имеются обозначения, указывающие увеличение, даваемое объективом (х8, х40, х90). Различают сухие и иммерсионные объективы. Объективы, дающие увеличение в 8 и 40 раз, называются сухими, так как при работе между объективом и препаратом находится слой воздуха. Иммерсионным называется объектив, при работе с которым между препаратом и объективом помещается капля иммерсионного (кедрового) масла (рис.2). Иммерсионное масло имеет оптический коэффициент преломления, близкий к коэффициенту преломления стекла, благодаря этому световые лучи, не отклоняясь от своего первоначального направления, попадают на линзу объектива. В рассматриваемом микроскопе объектив с увеличением х90 является иммерсионным. Общее увеличение, которое дает микроскоп, определяется произведением величины увеличения объектива на величину увеличения окуляра. Отчетливость получаемого изображения зависит от разрешающей способности микроскопа – минимального расстояния между двумя точками, воспринимаемыми раздельно. Световой микроскоп при освещении видимым светом имеет разрешающую способность около 0,2 мкм.