ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1149
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Первый день. Исследуемый материал засевают в несколько пробирок в среду накопления Китта-Тароцци градуированной или пастеровской пипеткой. Перед посевом эту среду прогревают в кипящей водяной бане 10-20 мин для удаления растворенного в ней воздуха, а затем охлаждают до 30-37 °С.
Часть пробирок с посевами прогревают в водяной бане при 80 °С 20 мин для уничтожения неспоровых форм бактерий. Затем все посевы культивируют в термостате при 37 °С.
В этот же день проводят заражение лабораторных животных исследуемым материалом.
Второй день. При росте анаэробов в среде Китта-Тароцци обнаруживают появление помутнения или помутнение и газообразование. Материал для приготовления мазков берут пастеровской пипеткой, которую опускают через слой масла до дна пробирки. Масло с поверхности стенок пипетки удаляют стерильной ватой при помощи пинцета. Эту операцию производят аккуратно над сосудом с дезинфицирующим раствором.
Мазки готовят обычным способом, фиксируют на пламени и окрашивают по Граму. При микроскопии регистрируют наличие грамположительных палочковидных форм (со спорами или без спор) и пересевают культуру из среды Китта-Тароцци на плотные питательные среды: для выделения чистой культуры и изучения культуральных свойств бактерий. Для этого подготавливают три чашки Петри с кровяно-сахарным МПА. Каплю материала со среды Китта-Тароцци наносят на поверхность плотной питательной среды, распределяют ее стеклянным шпателем. Этим же шпателем последовательно производят пересев на вторую и третью чашки.
Посевы на 24-48 часов помещают в анаэростат или другие приборы и инкубируют при 37 °С.
Изолированные колонии анаэробных микробов можно получить в глубине плотной питательной среды. Для этой цели используют также метод последовательного разведения с применением трубок Вейон-Виньяля или метод Перетца.
Третий день. Производят изучение выросших изолированных колоний и из типичных делают мазки и отсевают в среду Китта-Тароцци для выделения чистой культуры анаэробных бактерий.
Четвертый день. Из выросшей культуры на МППБ готовят мазки, окрашивают по Граму, проводят микроскопию и убеждаются в том, что выделена чистая культура бактерий.
Полученную культуру засевают на дифференциальные питательные среды: кровяно-сахарный МПА, сахарный МПА, молоко, на среду Вильсона-Блера.
Пятый день. Проводят идентификацию выделенной культуры из исследуемого материала по морфологическим, тинкториальным, культуральным, биохимическим, а также и вирулентным свойствам.
После гибели лабораторного животного от заражения производят бактериологическое исследование трупа. С этой целью из патологического материала готовят мазки, окрашивают их по Граму, проводят посев на МППБ и дифференциальные питательные среды.
При необходимости проводят исследования по обнаружению токсина биологическим методом на лабораторных животных.
Сроки лабораторного исследования на анаэробные инфекции колеблются от 8 до 15 дней.
Задания для самостоятельной работы
1. Ознакомиться с аппаратурой для культивирования анаэробов.
2. Провести посев кала на МППБ и на сахарный МПА, используя метод Веньяль-Вейона.
3. Ознакомиться с демонстрационным набором питательных сред для культивирования анаэробов и изменениями, происходящими в них при посевах.
Вопросы для самоподготовки и контроля знаний
1. Какие методы используют для создания анаэробиоза при культивировании анаэробных микроорганизмов?
2. Какие питательные среды применяют для культивирования анаэробов?
3. Особенности выделения культуры анаэробных микроорганизмов.
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
ЦЕЛЬ ЗАНЯТИЯ. Ознакомить и освоить технику микологических исследований. Изучить морфологию грибов, дрожжей, дрожжеподобных грибов и актиномицетов.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Готовые препараты, приготовленные из микроскопических грибов и актиномицетов, чистые культуры грибов на питательных средах, препаровальные иглы, микологические крючки, предметные и покровные стекла, 50%-ный водный раствор глицерина, раствор метиленовой сини, спиртовки, микроскопы; схемы, таблицы.
Грибы (Fungi) – низшие растения, характеризуются следующими свойствами: широко представлены в природе, не имеют хлорофилла, наличие у большинства видов вегетативных органов гиф, которые, переплетаясь, образуют мицелий. Они относятся к аэробам, по типу питания – метатрофы, нетребовательны к условиям внешней среды.
Значение микроскопических грибов (плесени) в патологии сводится к тому, что они могут вызывать различные болезни, а их токсины массовые отравления у животных и человека.
Болезни, вызываемые патогенными грибами у человека и животных, называют микозами.
К микозам относятся дерматомикозы: стригущий лишай (трихофития, микроспория), парша; бластомикозы, кандидамикозы, аспергиллезы и др.
Болезни, возникающие при поедании животными кормов, пораженных различными видами токсических грибов, называют микотоксикозами. К ним относятся фузариотоксикоз, аспергиллотоксикоз, дендродохиотоксикоз, клавицепстоксикоз и др. Патогенные и токсигенные грибы относятся к классам: зигомицеты, аскомицеты, базидомицеты, дейтеромицеты. Они отличаются друг от друга по типу мицелия, по наличию и строению органов плодоношения, по типу спор и другим признакам.
При морфологическом изучении у грибов устанавливают вегетативное тело, которое у большинства грибов состоит из тонких ветвящихся нитей – гиф, образующих сплетение – мицелий.
По строению мицелия грибы подразделяются на низшие и высшие.
У низших грибов (фикомицеты) гифы не септированы и они представляют собой одну гигантскую клетку с многочисленными ядрами без перегородок.
У высших грибов (микомицеты) гифы имеют перегородки, разделяющие их на отдельные одноядерные или многоядерные клетки, называемые септами (рис. 43).
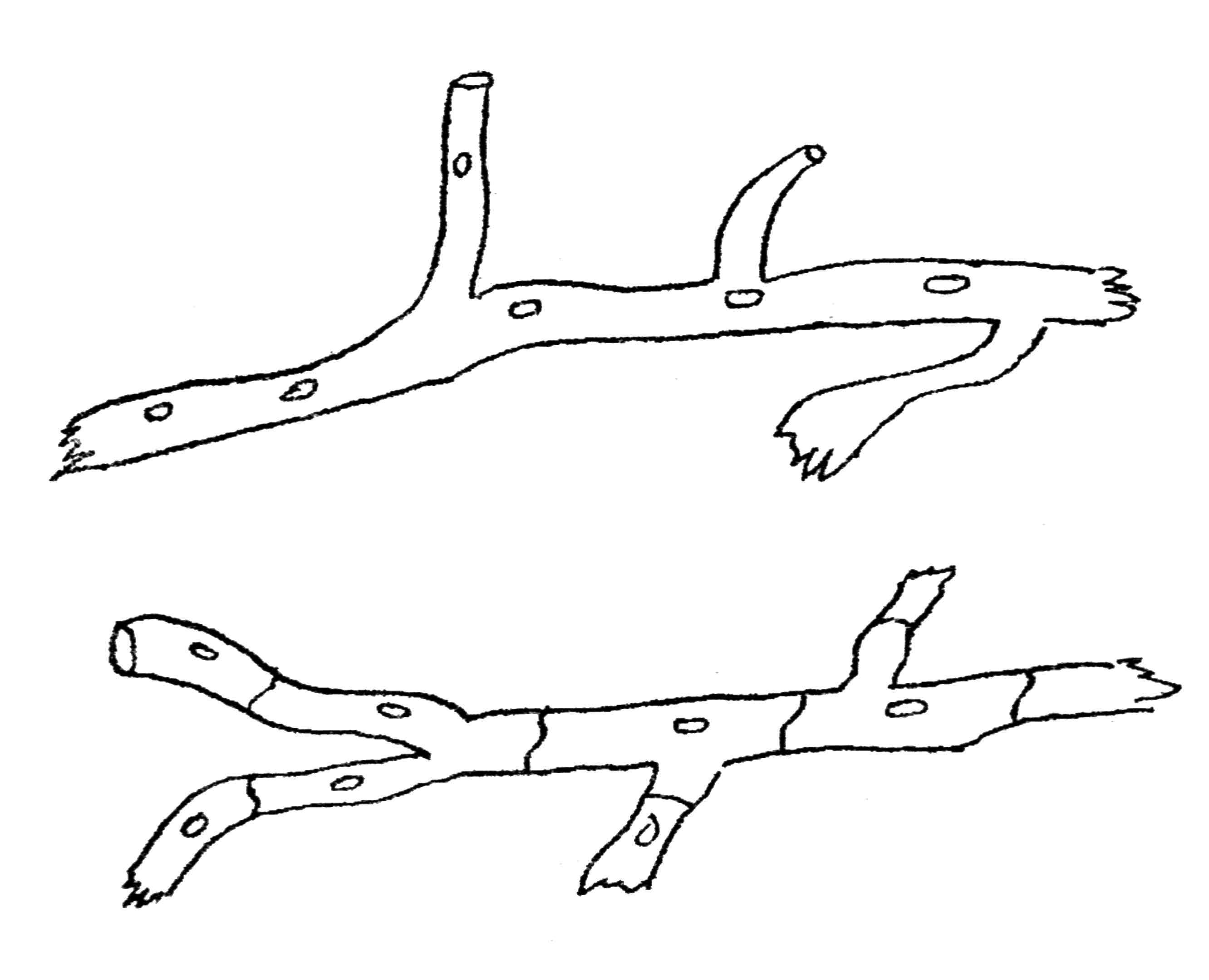
Рис. 43. Строение мицелий у микроскопических грибов: А — фикомицеты (мицелий не септирован); Б- микомицеты (мицелий септирован)
Другая группа грибов не образует мицелия – дрожжи, дрожжеподобные клетки, одноклеточные организмы, относящиеся к классу аскомицетов (сумчатые грибы).
Размножение грибов происходит двумя способами: вегетативным и репродуктивным. К последнему относится бесполое и половое размножение.
Вегетативное размножение может происходить за счет случайно оторвавшейся части мицелия.
Часть мицелия может превращаться в оидии (артроспоры), дающие начало новой грибнице. На более высших ступенях развития грибов на мицелии могут появляться хламидоспоры, которые отличаются от оидий более толстой оболочкой.
У дрожжей очень часто при размножении происходит простое деление клеток, которые остаются связанными вместе (почкование).
Репродуктивное размножение происходит с помощью спор, которые образуются бесполым и половым путем. Фикомицеты размножаются половым и бесполым путем. У микомицетов преобладает бесполое размножение.
Наиболее распространено бесполое размножение с помощью, спор, развивающихся на особых ответвлениях мицелия (спорангиеносцев), имеющих структуру мешков-спорангиев, в которых формируются споры (эндоспоры), характерные для низших мукоровых грибов, У грибов аскомицетов спорангии называют асками, а споры – аскоспорами.
Экзогенные споры – конидии – образуются на концевых участках особых гиф – конидиеносцы, которые могут быть простыми или разветвленными. У аспергиллов кониединосец на конце имеет округлое вздутие, на поверхности которого сплошным слоем расположены клетки в один или два ряда – стеригмы.
Микологическая диагностика сводится к:
1) микроскопии первичного исследуемого материала;
2) выделению чистой культуры возбудителя с использованием специальных питательных сред и определению его родовой и видовой принадлежности;
3) определению патогенных и токсигенных свойств на биологических моделях.
При микозах в лабораторию направляют соскобы с кожи с захватом волос на границе со здоровой тканью, соскобы со слизистых оболочек ротовой полости, молоко, трупы птиц и мелких животных и др.
При микотоксикозах направляют пробы кормов (солома, сено, зернофураж, комбикорм, отруби и др.), рвотные массы, от трупов – желудок, кишечник с содержимым, паренхиматозные органы и др.
Для микроскопического исследования на дерматоксикозы патологический материал предварительно обрабатывают 10-20%-ным раствором NаОН или КОН в течение 15-20 мин. Небольшое его количество препаровальной иглой или глазным пинцетом переносят на предметное стекло, добавляют 50%-ный водный раствор глицерина и накрывают покровным стеклом.
Микроскопию препарата «раздавленная капля» проводят под световым микроскопом с использованием объективов х8 и х40 в затемненном поле зрения (с прикрытой диафрагмой конденсора).
Морфологическая картина в препаратах, приготовленных из патологического материала, представлена: при трихофитии – мицелий не разветвлен, гифы и споры лежат правильными рядами вдоль волоса, при микроспории гифы и споры, по отношению к волосу, располагаются беспорядочно.
Для выделения чистой культуры микроскопических грибов проводят посевы на специальные питательные среды: сусло-агар, Сабуро, Чапека и др.
В состав суслового агара входит неохмеленное пивное сусло и 2 % агар-агара, среда Сабуро включает в себя глюкозу, пептон и агар-агар, среда Чапека – глюкозу, набор минеральных солей и агар-агар.
Посевы культивируют в термостате при 25-30°С.
Рост грибов на средах появляется на 7-10-й день.
При определении рода и вида грибов изучаются их морфологические особенности в динамике на питательных средах при соответствующих условиях. С этой целью колонии грибов, выросших на средах, микроскопируют под стереоскопическим или обычным микроскопом с объективом х8. Далее готовят препараты «раздавленная капля». Для этого препаровальными иглами или микологическим крючком отделяют небольшой участок мицелия с плодоносящими гифами и прилегающим к нему слоем питательной среды, переносят на предметное стекло в каплю 50%-ного водного раствора глицерина и придавливают покровным стеклом. Такие неокрашенные препараты микроскопируют как обычно.
Для выявления дрожжей и дрожжеподобных организмов готовят препараты для микроскопии, фиксируют физическим или химическим методами, окрашивают раствором метиленовой сини и микроскопируют.
Особенности строения некоторых низших и высших микроскопических грибов характеризуются следующими признаками.