ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1169
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
4. В сушильных шкафах сухим жаром стерилизуют:
А. Стеклянную посуду.
Б. Простые питательные среды (МПА и МПБ).
В. Вату, марлю.
Г. Термостойкие порошкообразные лекарственные вещества.
5. Споры бацилл погибают при:
А. Автоклавировании.
Б. Пастеризации.
В. Стерилизации сухим жаром.
Г. Длительном высушивании.
6. Каким из перечисленных методов стерилизации воспользовались, если применили следующий режим работы: дробная стерилизация при температуре 56-58° в течение 5-6 дней?
А. Автоклавирование.
Б. Пастеризация,
В. Тиндализация.
Г. Кипячение.
7. Каким из перечисленных методов стерилизации воспользовались, если применили следующий режим работы: при 1 атм - 120° в течение 20 мин?
А. Кипячение.
Б. Пастеризация.
В. Автоклавирование.
Г. Дробная стерилизация текучим паром.
8. Какой из методов наиболее приемлем для уничтожения бактериальных культур?
А. Пастеризация.
Б. Автоклавирование.
В. Фильтрование через бактериальные фильтры.
Г. Тиндализация.
9. Каким из перечисленных методов стерилизации воспользовались, если применили следующий режим работы: при температуре 100° в течение трех дней подряд по 30 мин в день?
А. Кипячение.
Б. Автоклавирование.
В. Пастеризация.
Г. Дробная стерилизация текучим паром.
10. Назовите режим работы, применяемый для пастеризации:
А. 100° - 30 мин.
Б. 60° - 20 мин.
В. 80° - 10 мин.
Г. 80° - 30 мин.
11. Назовите нормальный режим работы автоклава при стерилизации инфицированного материала:
А. 80° при давлении в 1,0 атм.
Б. 56° при давлении в 0,5 атм.
В. 126° при давлении 1,5 атм.
Г. 126° при давлении 2,0 атм.
12. Какой из перечисленных методов нужно применить для стерилизации питательных сред с углеводами:
А. Дробная стерилизация текучим паром.
Б. Кипячение.
В. Пастеризация.
Г. Автоклавирование.
13. Каким методом можно пастеризовать сыворотку крови:
А. Кипячением.
Б. Методом тиндализации.
В. Пастеризацией.
Г. Фильтрацией через бактериальные фильтры.
14. Дезинфицирующими веществами являются:
А. Хлорамин.
Б. Эритрин.
В. Стрептомицин.
Г. Фенол.
Д. Бриллиантовая зелень.
Тема 8. Методы посева бактерий на питательные среды (8.1), их культивирование (8.2), выделение чистых культур бактерий (8.3)
ЦЕЛЬ ЗАНЯТИЯ. Овладеть техникой посева бактерий на питательные среды, ознакомить с методами их культивирования, освоить методы и приемы выделения чистой культуры бактерий.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Пробирки со смесью бактерий разных видов (стафилококк, вакцинный штамм сибиреязвенной палочки, кишечной палочки). Питательные среды в пробирках: МПБ, скошенный МПА (по числу студентов), МПА (столбиком), среда Эндо, солевой МПА, чашки Петри. Бактериологические петли, шпатели. Предметные стекла, спиртовки, набор красок для окрашивания по Граму. Водяная баня на 100°С. Термостат.
8.1. Техника посевов бактерий на питательные среды
При первичных посевах из исследуемого материала или посева из чистых культур бактерий на питательные среды необходимо соблюдать строгую стерильность, чтобы не занести посторонних микробов. Все работы по посевам и пересевам бактерий проводятся в специальных помещениях (в боксах). Инструментами для посева и рассева микроорганизмов служат бактериологические петли, иглы, шпатель (рис. 22).
При посеве бактерий на питательные среды или пересеве из одной пробирки в другую соблюдают следующий порядок. Вначале в пламени горелки стерилизуют петлю и петледержатель, который при посеве входит в пробирку. Пробирку с чистой культурой со стерильной скошенной средой берут в левую руку в наклонном положении так, чтобы пробирка с культурой была первой по отношению к работающему. В правую руку берут, как писчее перо, петлю и, держа ее вертикально, прокаливают в пламени горелки. Ватные пробки захватывают мизинцем правой руки, вынимают и держат их во время посева в таком положении. Ни в коем случае не допускается класть пробки на стол. Обжигают края открытых пробирок в пламени горелки и вводят стерильную петлю в пробирку с культурой. Петлю охлаждают о внутреннюю стенку пробирки, прикасаются к участку незасеянного агара и, если он не плавится, прикасаются к поверхности культуры бактерий. Пробирку слегка отодвигают от пламени, предохраняя материал от сжигания. Быстро, но осторожно, переносят петлю в пробирку со стерильной средой, опускают, до конденсационной воды, и зигзагообразными движениями распределяют материал по скошенной поверхности агара. Извлекают петлю, обжигают края пробирок и вставляют обожженные пробки, затем стерилизуют петлю (рис. 23).
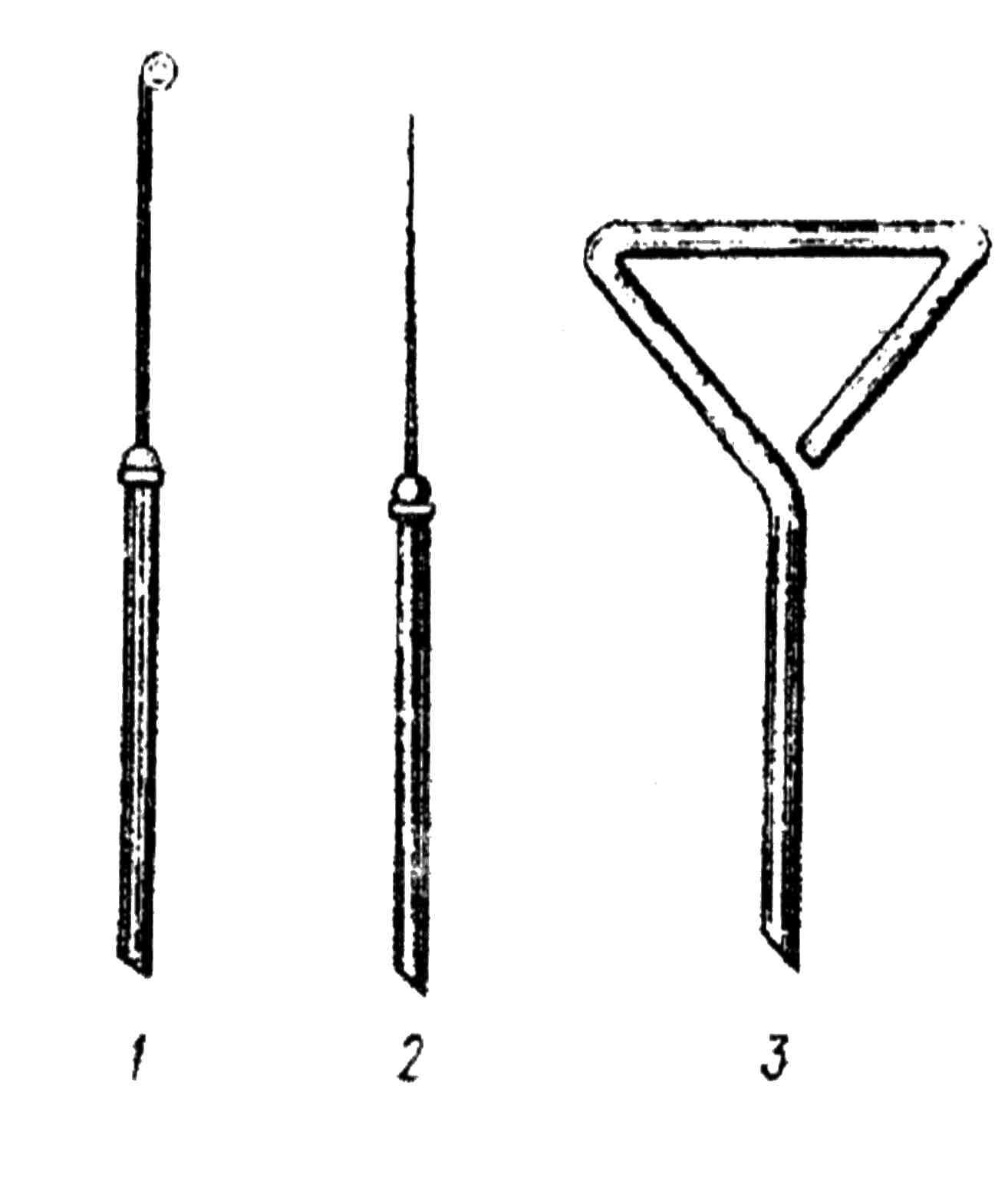
Рис. 22. Инструменты для посева и пересева микробов:
1 – бактериологическая петля;
2 – бактериологическая игла;
3 – шпатель
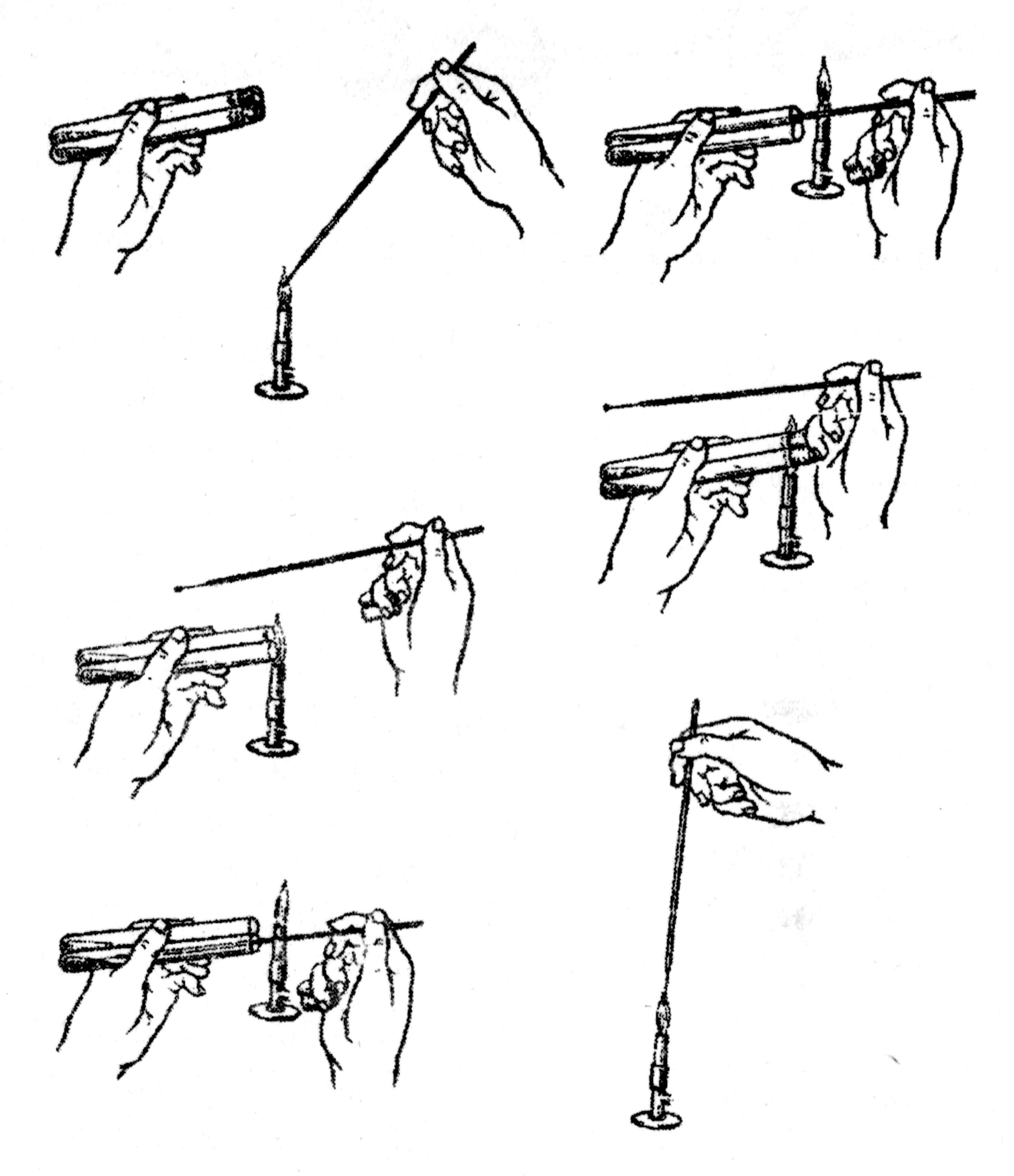
Рис. 23. Пересев из одной пробирки в другую
Посев на плотные среды в чашках Петри проводят бактериологической петлей или стеклянным шпателем. Крышка чашки с агаровой средой приподнимается левой рукой, но полностью не открывается, наносится капля исследуемого материала и растирается на поверхности среды (рис. 24).
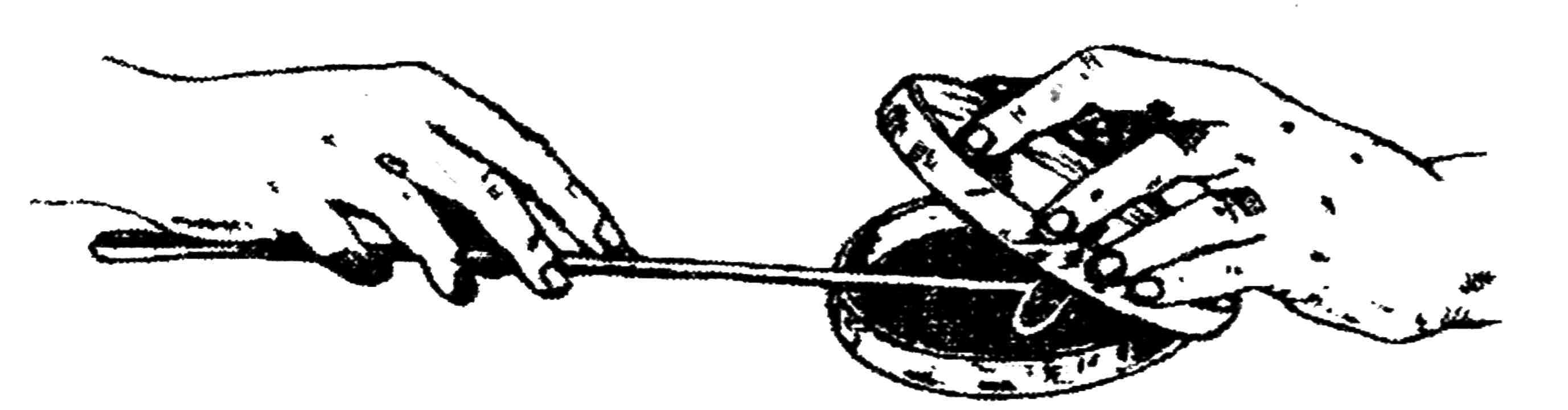
Рис. 24. Посев шпателем в чашку Петри с плотной питательной средой
При посеве уколом пробирку с агаром или желатином (среда разлита в виде столбика) держат дном вверх или под углом. Посев производят бактериологической иглой, которой прокалывают питательную среду до дна (рис. 25). Посев уколом в столбик применяется для выращивания анаэробов, выявления протеолитических свойств, а также с целью длительного хранения культур.
Для посева в жидкие среды пользуются петлей, стерильными градуированными или пастеровскими пипетками. Техника посева на жидкие среды петлей аналогична технике посева на скошенный агар, но материал на петле растирают по стенке пробирки и смывают питательной средой.
При пользовании пастеровской пипеткой кончик капилляра отламывается прокаленным пинцетом, пипетку проводят через пламя. На другой конец пипетки надевают резиновый баллончик и опускают ее в пробирку с жидким исследуемым материалом. Небольшое количество материала набирают путем легкого нажатия на баллончик и переносят материал в пробирку с незасеянной питательной средой, выдувая его с помощью груши.
После посева пастеровские пипетки помещают в дезинфицирующий раствор.
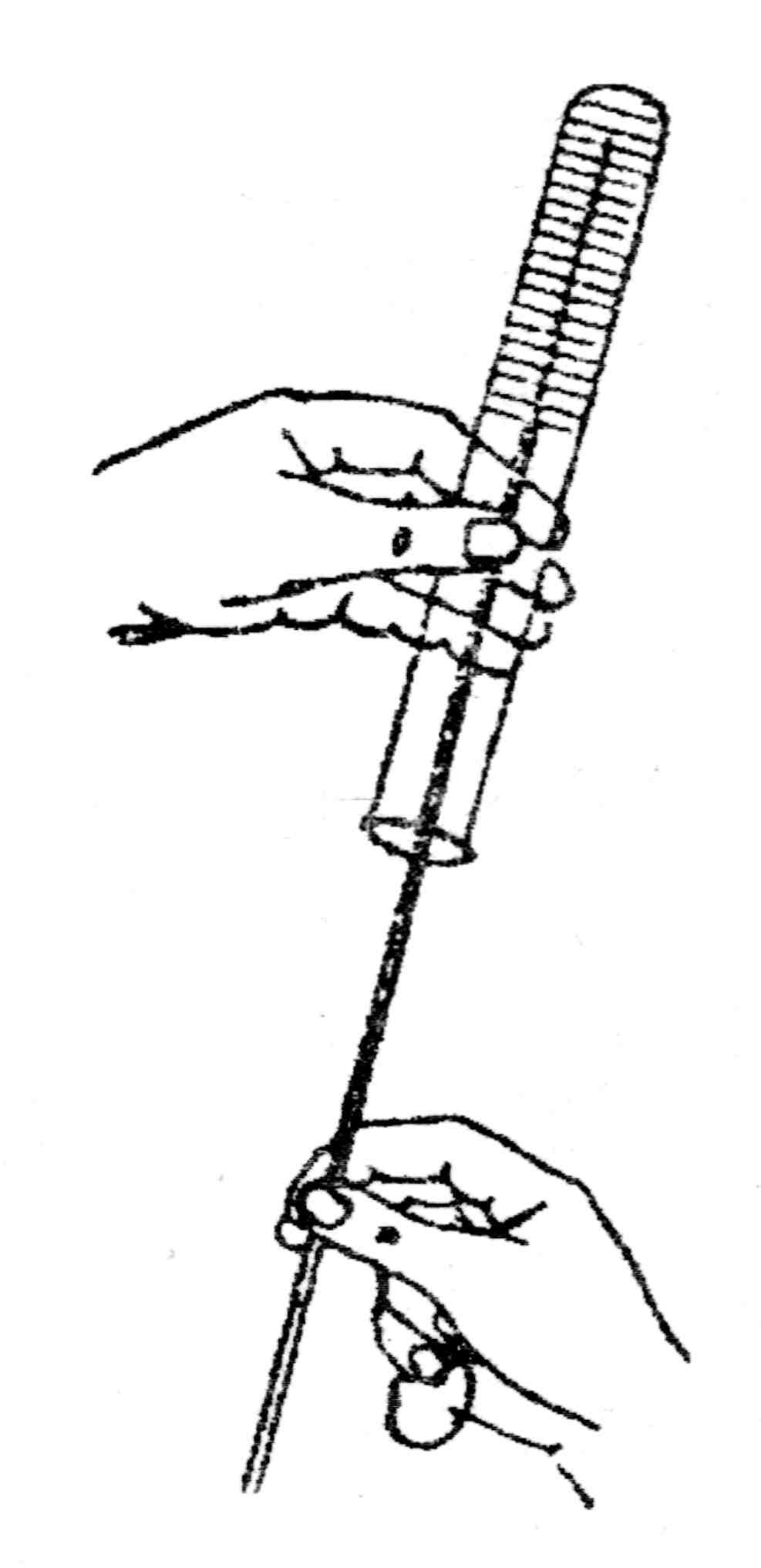
Рис. 25. Посев уколом в агар столбиком
8.2. Методы культивирования бактерий
Для успешного культивирования бактерий, кроме правильно подобранных сред и проведенного посева, необходимы оптимальные условия: температура, влажность, аэрация. В среднем температура для культивирования большинства микробов должна быть в пределах 37-38 °С.
Для выращивания микробов в лабораторных условиях используют специальный аппарат - термостат, в котором поддерживается постоянная и определенная температура (рис. 26).
Термостаты бывают различного устройства и размера. Термостат представляет собой шкаф с полками внутри и открывающейся дверцей, сделанные из теплоизолирующих материалов. Источником нагрева в современных термостатах являются электронагревательные элементы, которые прогревают воздух или воду.
Существенной частью любого термостата является система терморегуляции, которая обеспечивает поддержание температуры на оптимальном уровне. Датчиком температуры в большинстве термостатов является ртутный контактный термометр с магнитной головкой. Такой термометр имеет два контакта, один из которых представляет собой платиновую подвижную проволоку, заключенную в канал термометра, другой присоединяется к ртути. Уровень температуры по положению подвижного контакта регулируется магнитной головкой. При нагревании термостата выше 37° замыкаются контакты термометра, и сигнал поступает в электронное устройство, которое с помощью реле отключает источники нагрева. При снижении температуры контакты размыкаются и подается сигнал для включения источников нагрева. Таким образом, в термостатах постоянно поддерживается нужная температура.
В больших лабораториях по такому же принципу создаются комнаты-термостаты.
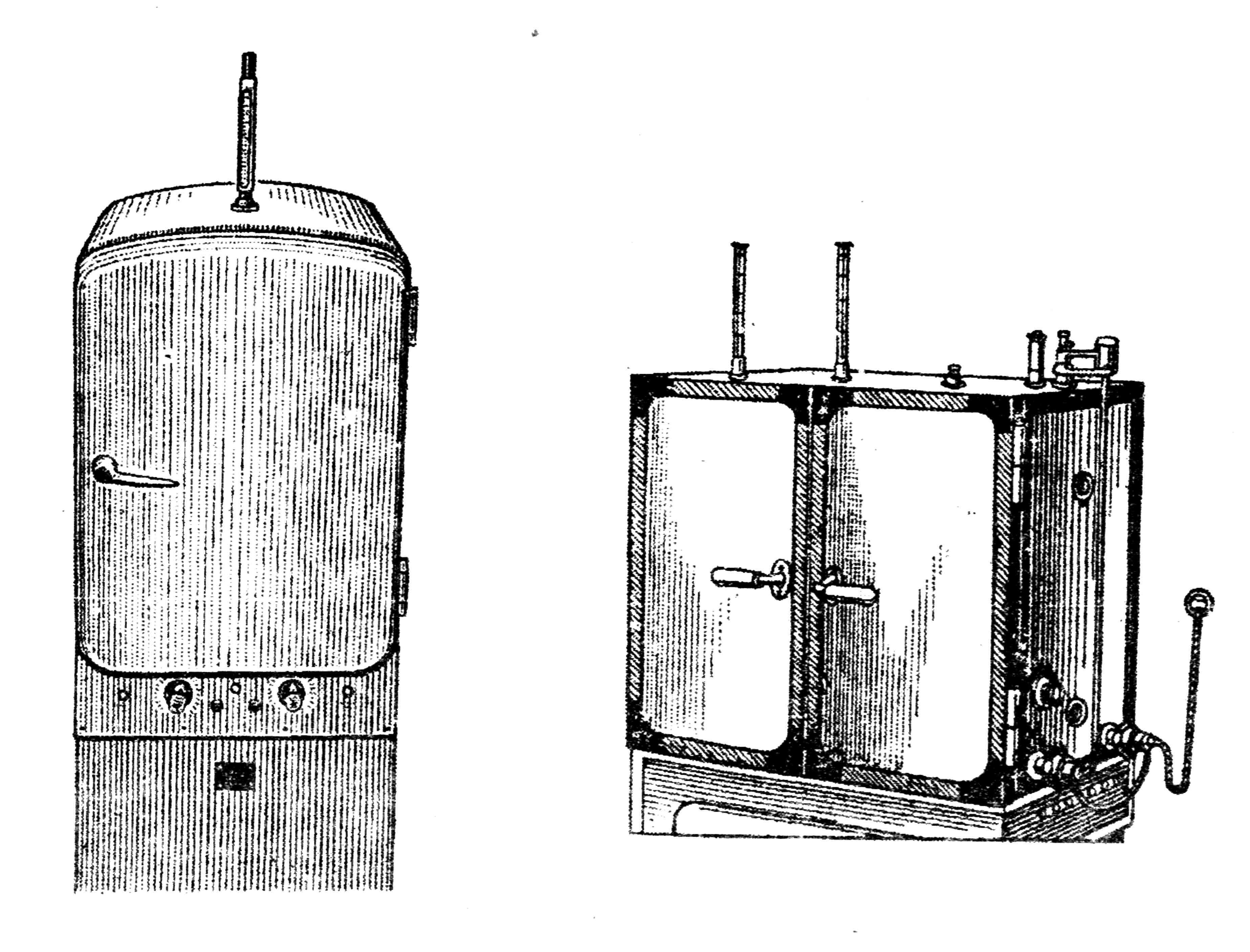
Рис. 26. Различные системы термостатов: сухо-воздушный (А), с водяной рубашкой (Б)
Свет подавляющему большинству патогенных микробов не нужен: их культивируют в темноте. Однако для изучения пигментообразования, которое происходит активнее на рассеянном свету, бактериальные культуры после термостата выдерживают 2-3 дня при комнатном освещении.
Для успешного культивирования бактерий необходимо применять свежие питательные среды, содержащие определенное количество влаги. Особенно это касается использования плотных питательных сред, которые разливают в чашки и скашивают в пробирках в день посева.