ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1194
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
Вскрытие грудной полости. Обжигают спиртом вскрытую поверхность (протирают спиртом и поджигают его). Пинцетом захватывают мечевидный отросток, делают поперечный разрез под ним и два продольных, перерезая ребра в местах их соединения с хрящами. Лоскут в виде треугольника (основание у диафрагмы, а вершина у ключиц) откидывают вверх и изучают органы грудной клетки, отмечают наличие экссудата, производят посев крови и делают препараты-отпечатки из ткани легких. Кровь из сердца берут пастеровской пипеткой. Предварительно разрезают сердечную сорочку и прижигают поверхность мышцы сердца, прикладывая раскаленный скальпель.
Капилляр пипетки вводят в область желудочка или предсердия через прижженное место, кровь сама поступает в капилляр, после чего пипетку извлекают, кровь сеют на питательные среды, а из остатка делают мазки.
Вскрытие брюшной полости. Осторожно, чтобы не захватить петлю кишки, приподнимают пинцетом брюшную стенку, делают ножницами разрез диафрагмы до лобка и два поперечных. Отвернув мышечные лоскуты, исследуют органы брюшной полости, обращая внимание на величину, цвет и консистенцию селезенки, печени, надпочечников. Обязательно производят посевы из тканей селезенки, печени, мезентериальных лимфатических узлов и экссудата. Материал для посева берут петлей. Поверхность органа прижигают раскаленным скальпелем и производят разрез в этом участке; петлей делают соскоб в месте разреза и сеют на питательные среды. Для приготовления мазков вырезают небольшой кусочек ткани, берут его пинцетом и прикасаются к поверхности предметного стекла местом среза (препарат-отпечаток) или распределяют тонким слоем.
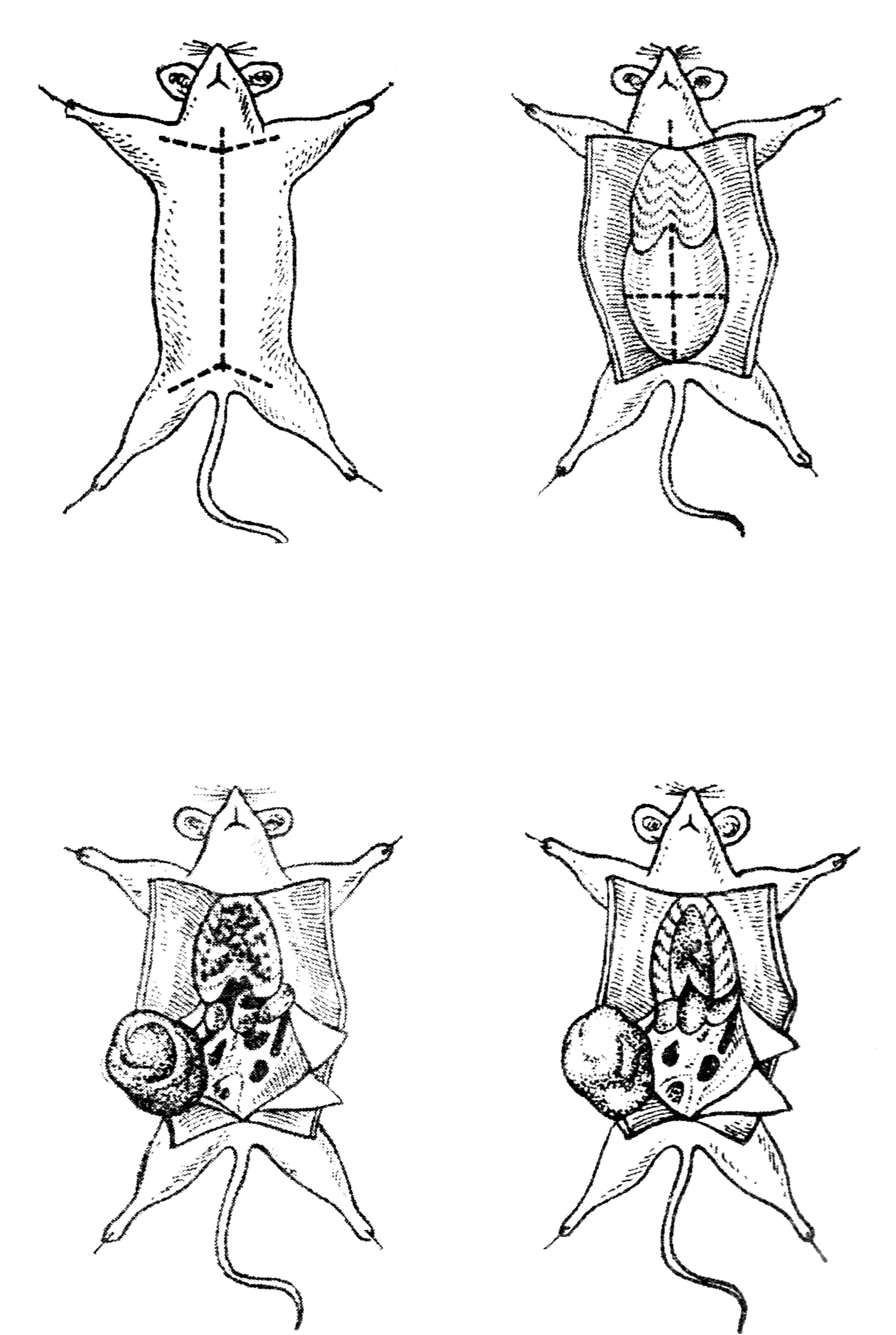
Рис. 39. Вскрытие трупа белой мыши
Труп животного после вскрытия сжигают, автоклавируют или кипятят в течение одного-двух часов в карболовом растворе. Все инструменты стерилизуют в автоклаве под давлением или кипячением в стерилизаторе.
Задания для самостоятельной работы
1. Заразить лабораторных животных (белые мыши, морские свинки, кролики) различными способами: подкожно, внутримышечно, внутрибрюшинно, внутривенно. В качестве материала для введения использовать стерильный физиологический раствор.
2. Вскрыть труп белой мыши, погибшей от заражения вакцинным штаммом возбудителя сибирской язвы (II вакцина Ценковского)
3. Приготовить мазки-отпечатки из органов, окраска по Граму на капсулу, провести микроскопию. Посев из внутренних органов на МПА и МПБ.
4. Занести в бланк-экспертизу данные по заражению, вскрытию и исследованию трупа животного.
Вопросы для самоподготовки и контроля знаний
1. С какой целью проводят заражение лабораторных животных?
2. Какие виды лабораторных животных используют для экспериментального заражения?
3. Какие методы используют для заражения животных?
4. В каких условных единицах измеряют вирулентность микроорганизмов?
5. Раскрыть сущность метода бактериологического исследования трупа животного.
Тема 14. Культивирование анаэробных микроорганизмов
ЦЕЛЬ ЗАНЯТИЯ. Ознакомить и освоить методы, применяемые при работе с анаэробными микроорганизмами.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ. Анаэростат, эксикатор, вакуумный насос (водоструйный или масляный), водяная баня; питательные среды: МППБ, кровяно-сахарный агар (Цейсслера), сахарный агар, молоко, среда Вильсона-Блера; стерильные чашки Петри, трубки Веньяль-Вейона, стеклянные пластинки 6x6, пастеровские пипетки, спиртовки; таблицы, схемы.
К группе патогенных анаэробных микроорганизмов принадлежат возбудители эмфизематозного карбункула, столбняка, ботулизма, злокачественного отека, дизентерии ягнят, брадзота, энтеротоксемии, некробактериоза.
Для выделения и культивирования анаэробных микроорганизмов необходимы следующие условия, которые сводятся к созданию анаэробиоза, а также к использованию специальных питательных сред.
Создание анаэробиоза достигается несколькими методами.
1. Физический метод. Заключается в том, что посевы помещают в герметичный сосуд, из которого выкачивают воздух и помещают его в термостат. В этих целях применяют ряд приборов, из которых наиболее распространенным является анаэростат (рис. 40). Он представляет собой толстостенный металлический цилиндр, закрывающийся сверху массивной, хорошо притертой крышкой. Для создания наибольшей герметизации между крышкой и корпусом помещена резиновая прокладка. Внутри находится этажерка для размещения чашек Петри. В крышке прибора вмонтированы кран и вакуум-манометр.
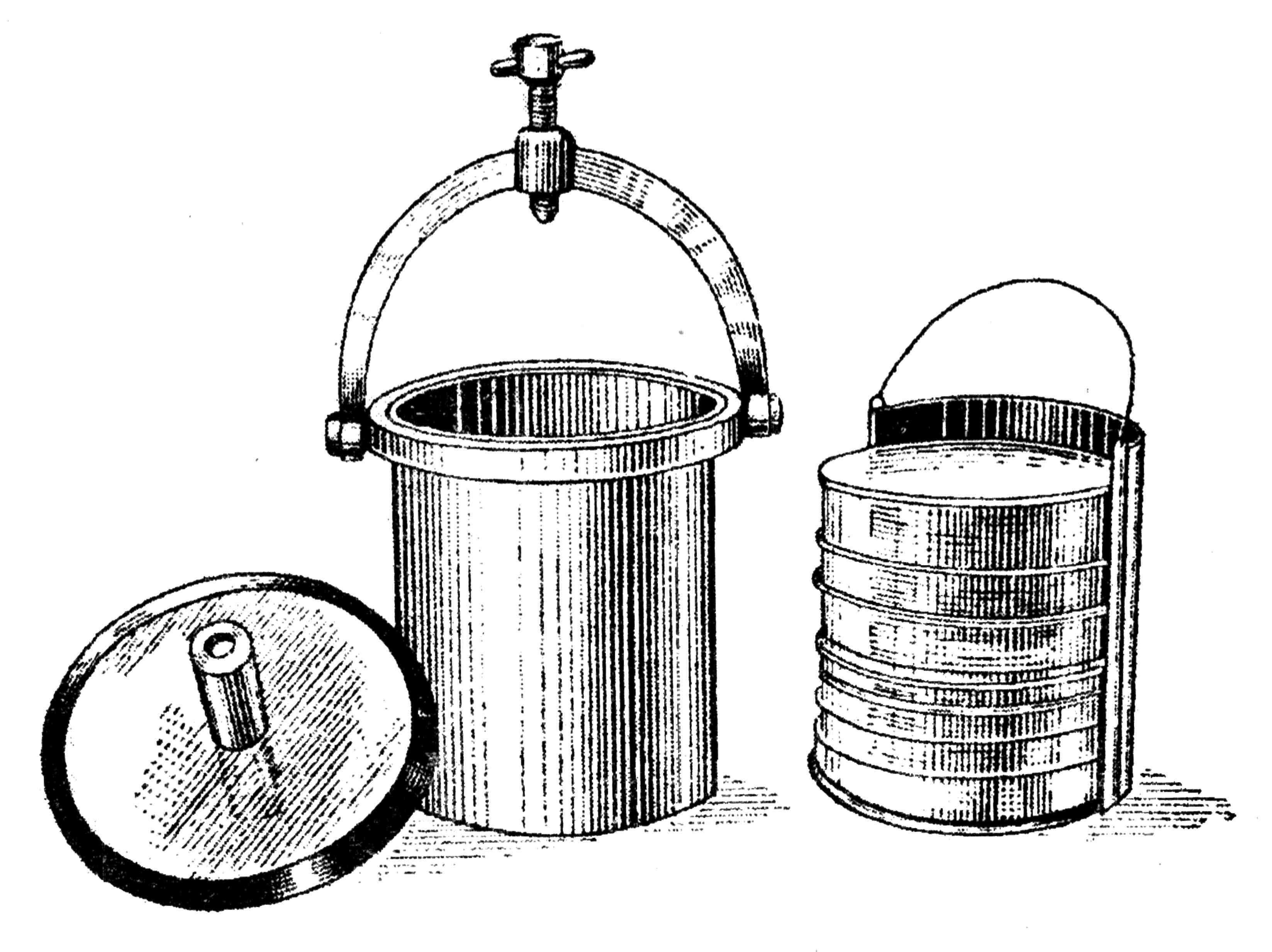
Рис 40. Анаэростат для выращивания анаэробных бактерий
После того как во внутрь анаэростата помещены чашки Петри с посевами, его закрывают крышкой, которую фиксируют винтом. К открытому крану присоединяют масляный вакуумный насос и необходимую степень разряжения устанавливают по показателю вакуум-манометра. Когда воздух откачен, кран закрывают и анаэростат отсоединяют от насоса, а затем помещают в термостат.
При отсутствии анаэростата для выращивания анаэробов можно использовать эксикатор с краном в крышке.
2. Химический метод заключается в том, что в сосуд с посевами помещают химические реагенты, жадно поглощающие кислород. Для этого используют эксикаторы (рис. 41). В эксикатор помещают чашки Петри с посевами и открытую чашку с 10%-ным раствором едкого натра. На бортик эксикатора помещают пакетик с сухим пирогаллолом. Крышку эксикатора закрывают и легким движением высыпают пирогаллол в раствор едкого натра. Происходит мгновенная реакция с поглощением кислорода. В качестве поглотителя кислорода можно использовать также реакцию между углекислой содой и гидросульфитом натрия.
3. Комбинированный метод. Посевы помещают в эксикатор с краном и из него удаляют воздух механическим методом. Предварительно в эксикатор помещают химические реагенты – поглотители кислорода, которые дополнительно создают анаэробные условия.
4. Биологический метод создания анаэробиоза основан на совместном выращивании анаэробов и аэробов на плотных питательных средах в загерметизированных чашках Петри (рис. 42). Вначале вырастают аэробы, которые используют кислород, при ого отсутствии начинают расти анаэробы. Этот метод ненадежен и может быть использован только для культивирования нестрогих анаэробов.
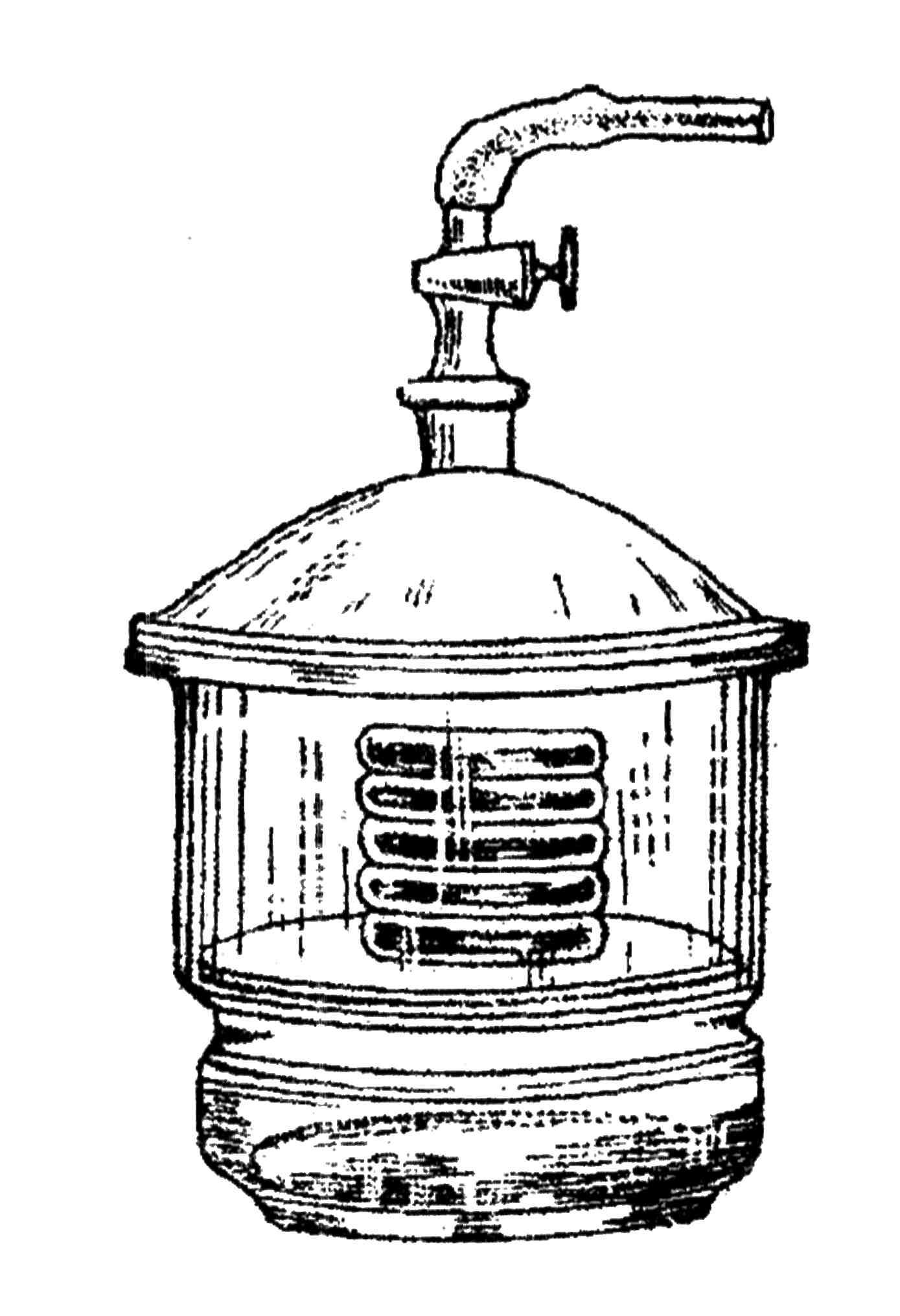
Рис. 41. Эксикатор, который используют для создания анаэробных условий физическим или химическим методами
Питательные среды, на которых выращивают анаэробы, по своему составу аналогичны обычным средам. Отличаются лишь тем, что они сами по себе должны создавать анаэробные условия. С этой целью питательные среды разливаются высоким столбиком, до посева жидкие среды кипятят для удаления из них кислорода, а на их поверхность наслаивают вазелиновое масло для изоляции от атмосферного кислорода. Кроме этого в состав питательных сред входят различные редуцирующие вещества, уменьшающие содержание в них свободного кислорода. В качестве редуцирующих веществ обычно используют глюкозу (1-2%-ную), муравьинокислый натрий 0,3-0,5%-ный и пр. Часто в жидкие питательные среды опускают какие-либо пористые вещества (кусочки тканей, пемзу, вату), которые адсорбируют на своей поверхности воздух.
Для выделения анаэробных бактерий из патологического материала, а также для их накопления и сохранения используют жидкую питательную среду Китта-Тароцци (мясо-пептонный печеночный бульон — МППБ). В состав МППБ входит печеночный экстракт с МПБ (1:1), который разливают по пробиркам высоким столбиком. На дно пробирки предварительно помещают кусочки вареной печени, а сверху после разлива среды наслаивают вазелиновое масло.
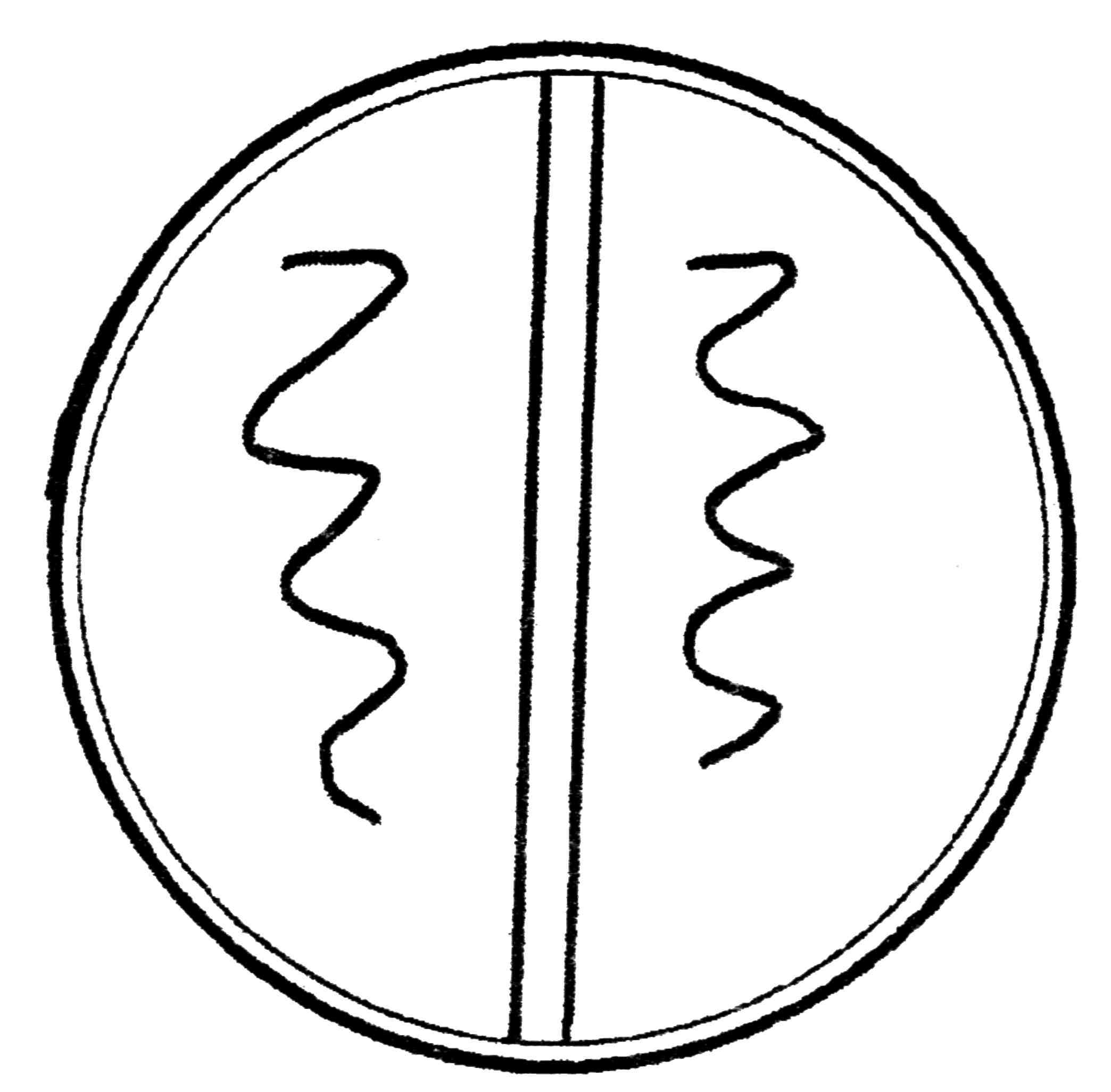
Рис. 42. Биологический метод создания анаэробиоза: совместное выращивание аэробных (I) и анаэробных (II) бактерий
В ряде случаев к МППБ добавляют стерильный раствор глюкозы в количестве 0,5 % (в пересчете на сухое вещество).
Для дифференциации патогенных анаэробов используют среды: кровяной агар Цейсслера, сахарный МПА, молоко, железо-сульфатный агар (среда Вильсона-Блера) и др.
Кровяной агар (Цейсслера): 3%-ный мясо-пептонный агар с 1-2 % глюкозы, смешивают (при температуре 50 °С) с 15-20 % свежей де-фибринированной крови барана, крупного рогатого скота, лошади.
Пользуются также кровью кролика или морской свинки, добавляя ее в количестве 5-7 %. Питательную среду разливают по чашкам Петри и подсушивают в термостате 20-30 мин. После посева культуры выращивают в анаэробных условиях.
Сахарный агар готовят на бульоне Мартена с добавлением 0,1 % глюкозы и 2 % агар-агара.
Молоко обезжиривают и разливают по пробиркам высоким столбиком и сверху наслаивают вазелиновое масло.
Железо-сульфитный агар (Вильсона-Блера). К 100 мл 3%-ного МПА с 10% глюкозы прибавляют 10 мл 20%-ного раствора сульфита натрия и 1 мл 8%-ного раствора хлорида железа. Черные колонии образуют анаэробные бактерии за счет восстановления сульфита натрия в сульфат натрия, который, соединяясь с хлорным железом, образует черный осадок сульфида железа.
Изолированные колонии анаэробов можно получить, используя различные методы.
Метод Виньяль-Вайона основан на том, что исследуемый материал разводят в расплавленном до 45 °С сахарном МПА. Затем из каждой пробирки быстро насасывают агар в стерильную пастеровскую пипетку. Тонкий конец пипетки запаивают. Запаянные пипетки помещают в термостат в стеклянном цилиндре. В зависимости от исходной концентрации в той или иной пипетке через 2-3 суток после посева можно наблюдать образование изолированных колоний. При необходимости исследовать колонию, трубку надпиливают и разламывают, а столбик агара выдавливают в чашку Петри и извлекают колонии бактериологической петлей.
Получить изолированные колонии анаэробов можно, используя метод Перетца. Для этого в чашки Петри помещают стеклянные палочки или спички и на них укладывают стеклянные пластинки размером 6x6 см. Исследуемый материал разводят расплавленным и остуженным сахарным МПА. Содержимое пробирок быстро перемешивают и выливают в чашки таким образом, чтобы агар заполнил пространство между стеклянной пластинкой и дном чашки. Толщина агарового слоя под стеклом должна быть равна 1-2 мм. Посевы инкубируют в термостате при 37°С. Через 18 ч под пластинкой вырастают колонии анаэробов. Выделение чистых культур анаэробных бактерий проводится в следующем порядке.