ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1116
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
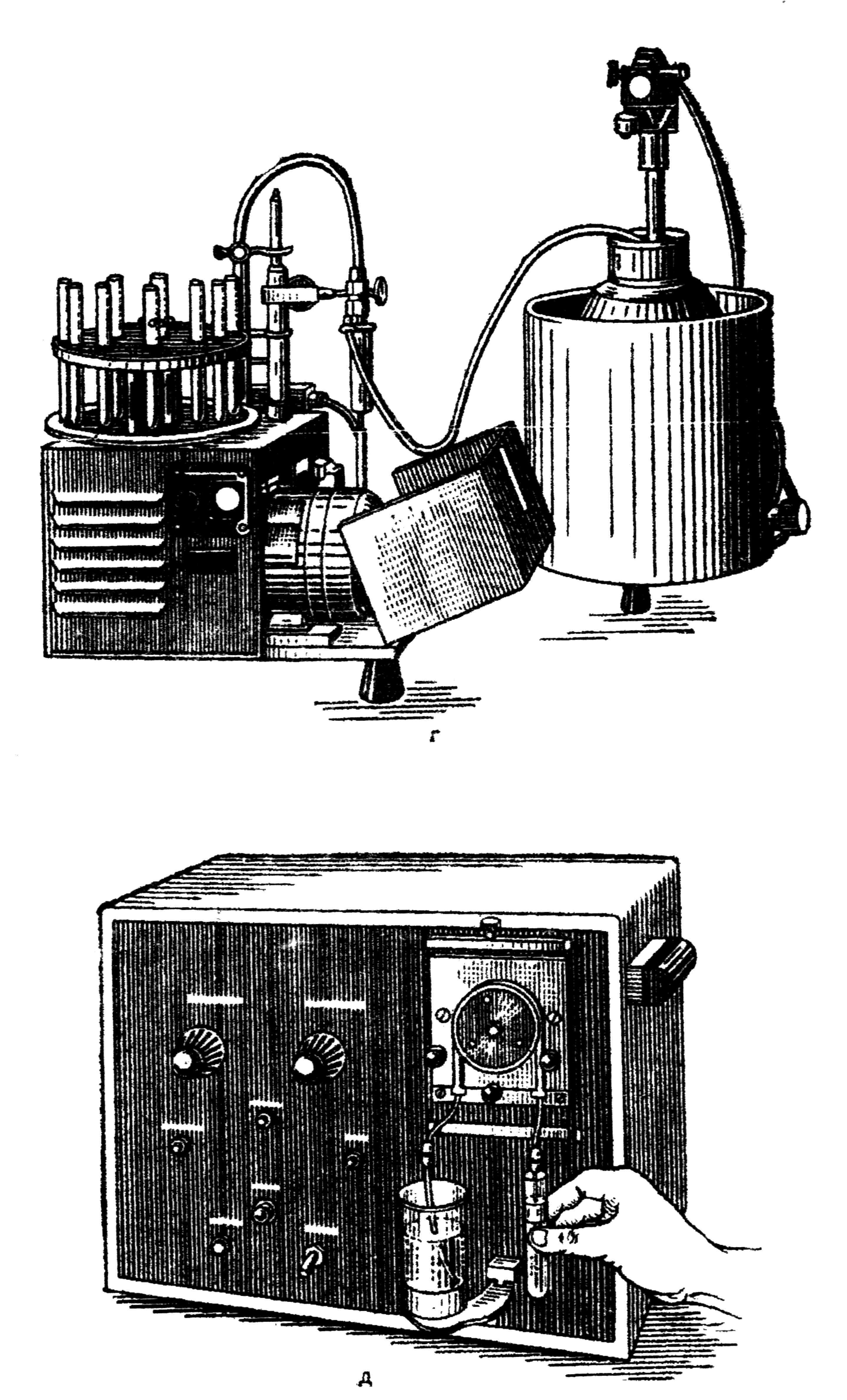
Рис. 14. Аппаратура для мерного разлива питательных сред
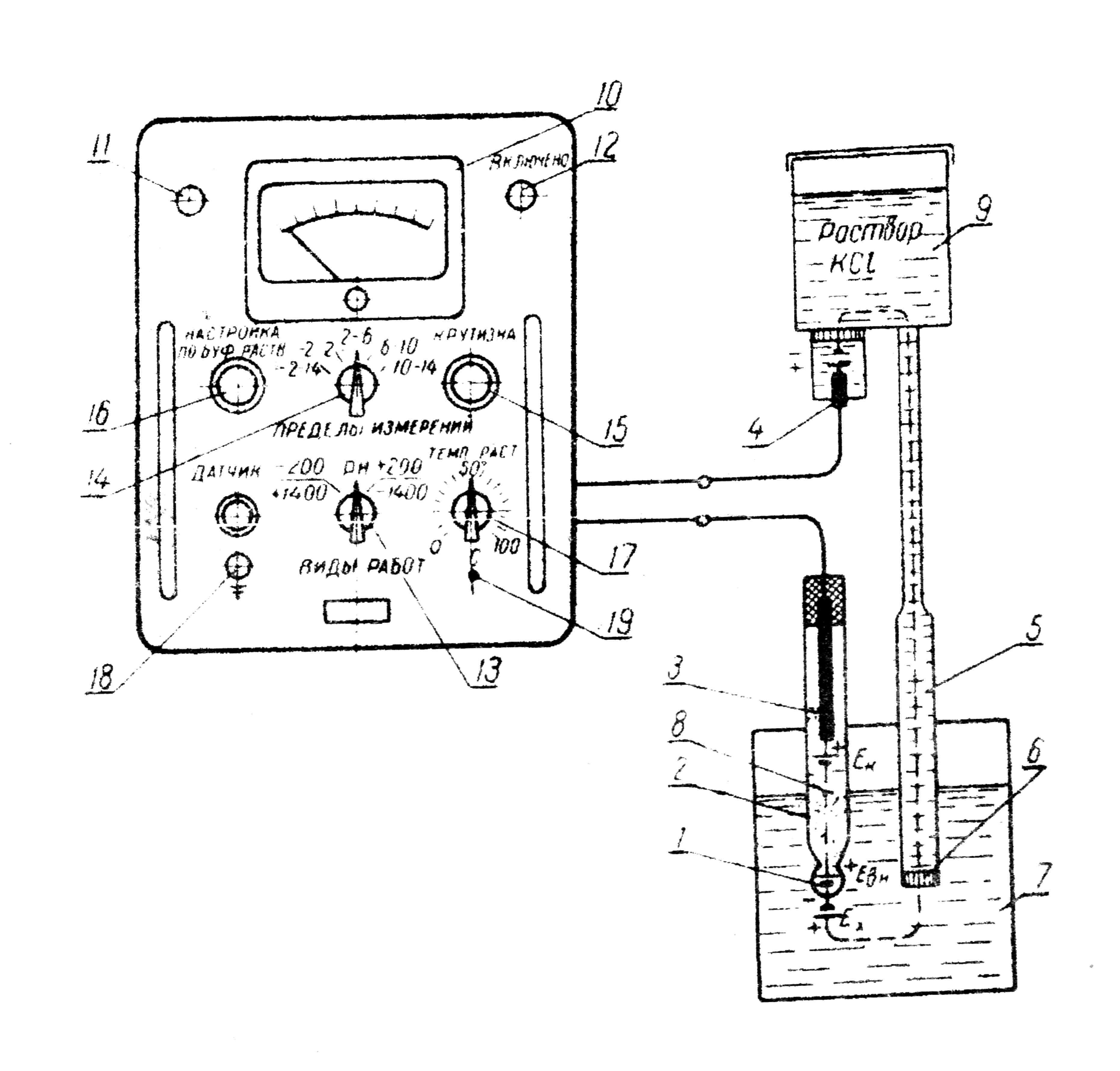
Рис. 15. Схема лабораторного рН-метра ЛПУ-01 и его электронной системы: 1 – полый шарик из электродного стекла; 2 – стеклянный электрод; 3 – внутренний контактный электрод; 4 – вспомогательный электрод; 5 – электролитический контакт; 6 – пористая перегородка; 7 – контролируемый раствор; 8 – раствор, заполняющий внутреннюю полость электрода; 9 – раствор КСl; 10 – показывающий прибор; 11 – светофильтр контрольной лампы; 12 – тумблер; 13 – переключатель вида работ; 14 – переключатель пределов измерения; 15 — переменное сопротивление настройки крутизны; 16 – переменное сопротивление настройки по буферному раствору; 17 – переменное сопротивление ручной температурной компенсации; 18 — клемма заземления датчика; 19 – винт фиксации узла ручного температурного компенсатора
Вопросы для самоподготовки и контроля знаний
1. Какие компоненты используются при приготовлении МПБ?
А. Мясной экстракт, пептон, поваренная соль.
Б. Мясной экстракт, пептон, агар-агар.
В. Водопроводная вода, поваренная соль, пептон.
Г. Мясной экстракт, пептон, соль, сыворотка крови.
2. С какой целью при приготовлении МПА включают 2-3 % агар-агара?
А. Для повышения питательных свойств среды.
Б. Для создания плотной консистенции.
В. Для установления рН.
Г. Для создания изотоничности.
3. Установите, в качестве какого источника питания для бактерий служит пептон, входящий в состав многих питательных сред?
А. Углеродного.
Б. Азотистого.
В. Минерального.
4. Мясо-пептонный агар по консистенции относится к средам:
А. Жидким.
Б. Плотным.
5. К какой группе относятся питательные среды по применению?
А. Мясо-пептонный агар и мясо-пептонный бульон.
Б. МПБ и МПА с желчью, с сывороткой крови.
В. Среда Эндо, среда Гисса.
Г. МПА с 10 % поваренной соли для стафилококков.
1. Обычные питательные среды.
2. Дифференциально-диагностические.
3. Специальные.
4. Элективные.
6. С какой целью используют элективные питательные среды?
А. Для выделения определенной группы или вида бактерий.
Б. Для накопления бактерий.
В. Для дифференциации.
7. Какой рН питательных сред для выращивания многих патогенных бактерий является оптимальным?
А. 7,2 – 7,4.
Б. 6,4 – 6,6.
В. 7,8 – 8,0.
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
ЦЕЛЬ ЗАНЯТИЯ. Ознакомить с методами стерилизации, применяемыми в микробиологической практике, их назначением; приборами и аппаратурой для проведения стерилизации. Научить основным принципам подготовки к стерилизации лабораторной посуды, питательных сред, инструментов и др.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. 1. Спиртовки, стерилизатор (кипятильник), сушильный шкаф, текучепаровой аппарат (Коха), автоклав, бактерицидные лампы (в сборе), свечи, асбестовые фильтры, аппарат Зейтца, 2. Чашки Петри, пипетки, бумага для завертывания, вата.
Стерилизацией называют процесс, направленный на полное уничтожение всех живых микроорганизмов в стерилизуемых объектах как в лабораториях, так и в промышленных условиях.
Большое разнообразие стерилизуемых объектов потребовало разработки различных методов стерилизации.
Главными требованиями в стерилизации являются ее надежность и сохранение качества стерилизуемых объектов.
Различают физический, химический и механический методы стерилизации. К физическим методам стерилизации относят действие высокой температуры, ультрафиолетовых лучей, ионизирующей радиации, ультразвука и др. Химические методы используют для обработки вакцин, сывороток и других объектов, консервируемых различными антисептиками. Механический метод – фильтрация жидкостей через бактериальные фильтры. С помощью этого метода механически очищают жидкость от бактерий. Фильтрующиеся формы бактерий, вирусы через такие фильтры проходят.
7.1. Физические методы
А. Термическая обработка
Имеется множество вариантов, но термическая обработка применима лишь в отношении термоустойчивых материалов и сред.
1. Стерилизация в пламени (фламбирование). Этот способ применяется для стерилизации бактериологических петель, игл, предметных и покровных стекол, пинцетов и других мелких металлических и стеклянных предметов.
2. Стерилизация кипячением используется в основном для обработки игл, шприцев, хирургических инструментов. Она проводится в специальных стерилизаторах (рис. 16) в течение 30 минут. Для повышения точки кипения и устранения жесткости воды добавляют 1 % соды. Этот метод не обеспечивает полной стерилизации, так как споры некоторых бацилл выдерживают кипячение в течение нескольких часов.
3. Стерилизация сухим жаром проводится в сухожаровых шкафах, рис. 17, (металлических двустенных шкафах, изолированных асбестом или линолеумом, с отверстием в верхней части для термометра). Электрические аппараты для стерилизации горячим воздухом разнообразны по форме, снабжены хорошей тепловой изоляцией.
Необходимая температура поддерживается автоматически при помощи терморегулятора, работу которого можно наблюдать с помощью контрольной лампы. Стерилизуют горячим воздухом при 160°С в течение 1,5 часа с момента достижения этой температуры.
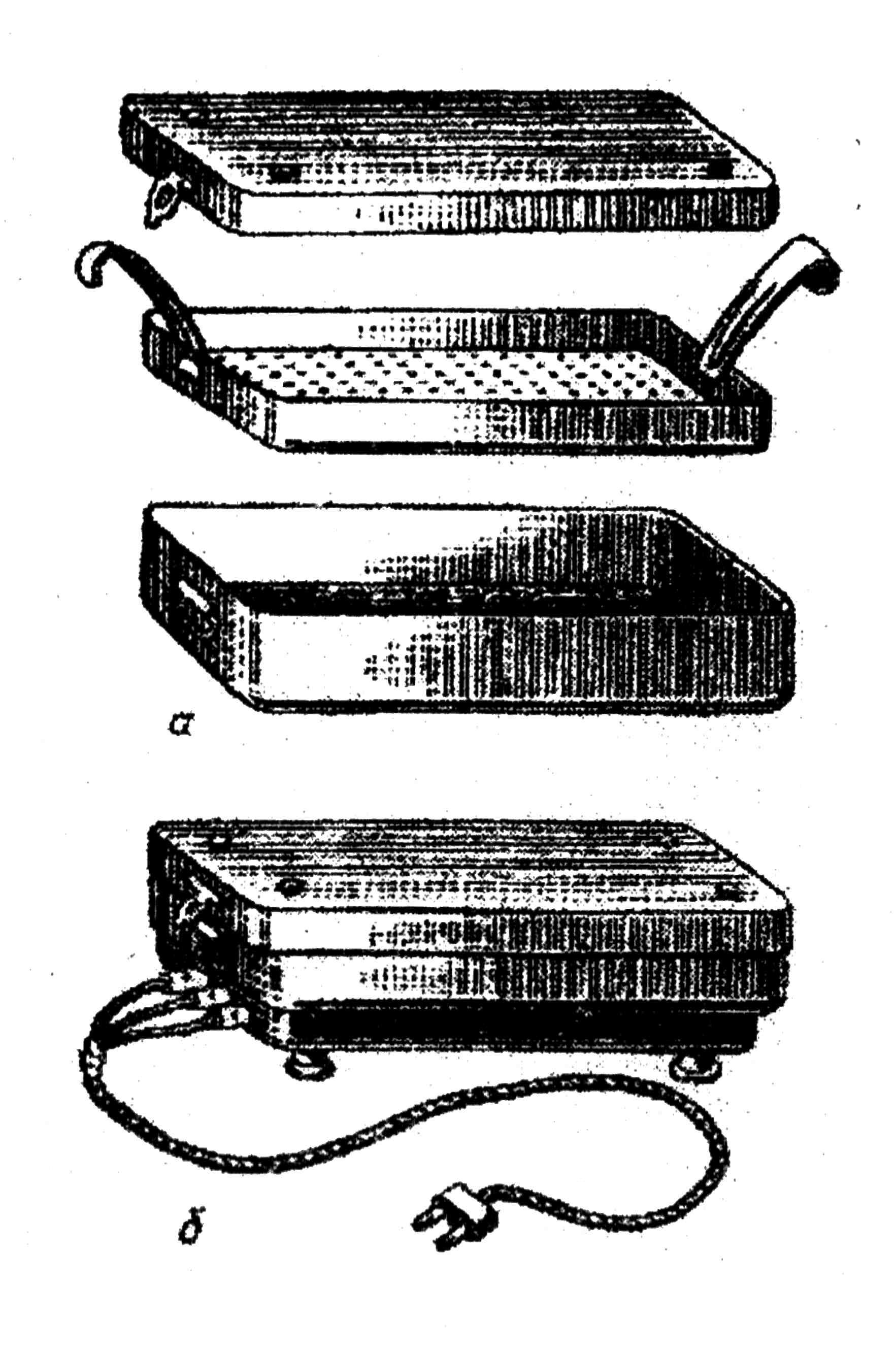
Рис. 16. Стерилизатор-кипятильник
При 170°С бумага и вата желтеют, при более высоких температурах обугливаются. В сухожаровых шкафах стерилизуют лабораторную посуду: чашки Петри, вложенные в специальные металлические пеналы или обернутые в бумагу по одной или несколько штук в пачке, пастеровские и градуированные пипетки, закрытые с одного конца ватой, находящиеся в металлических пеналах или завернутые в бумагу по 10-15 штук. Пробирки и колбы закрывают ватными пробками.
4. Стерилизация паром является наиболее эффективным методом и осуществляется двумя способами: насыщенным паром под давлением и текучим паром.
а) Стерилизация паром под давлением производится в автоклаве (рис. 18, 19), который представляет собой толстостенный котел цилиндрической формы, покрытый снаружи кожухом, закрывающийся крышкой.
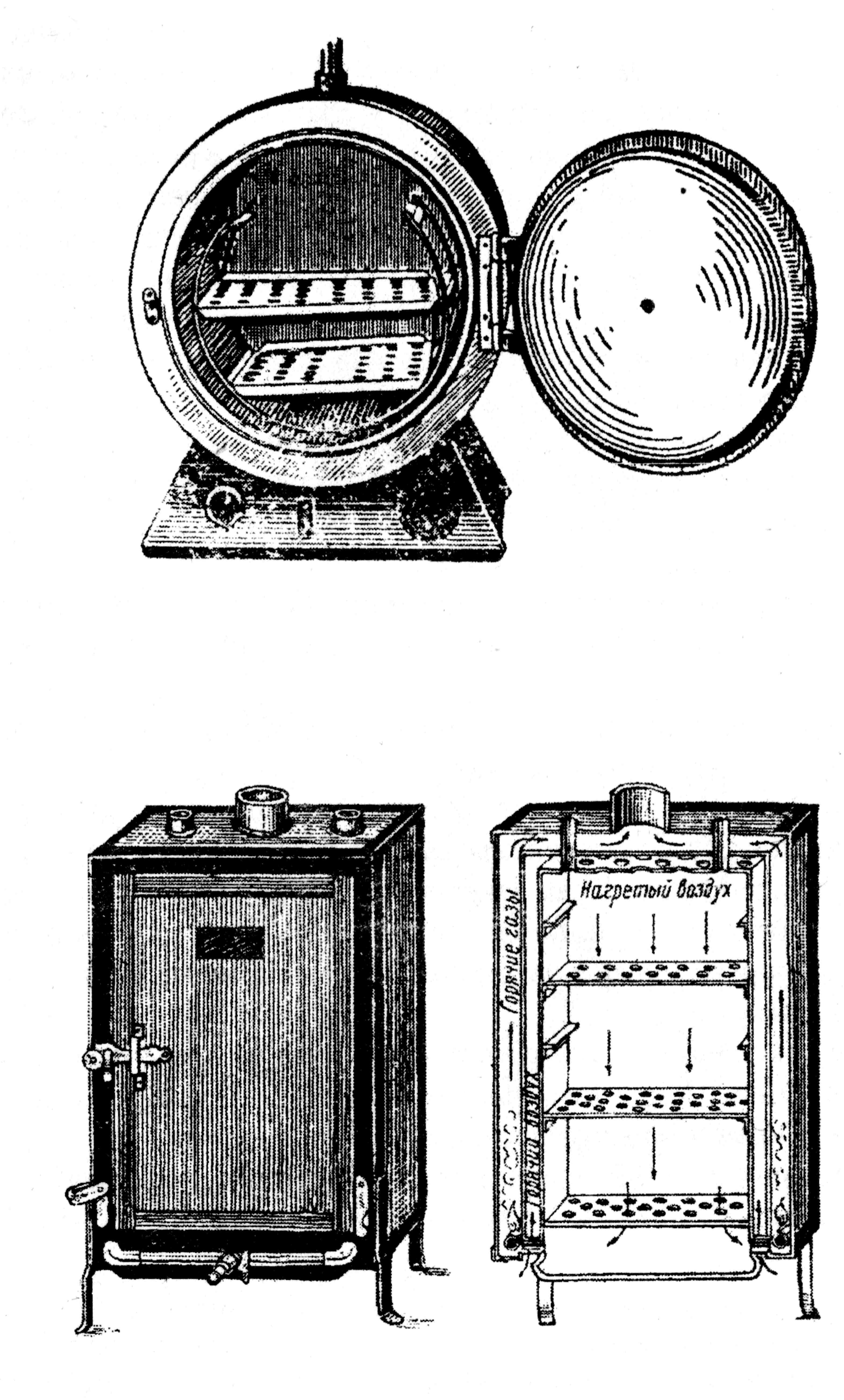
Рис. 17. Сушильные шкафы различной конструкции для стерилизации сухим нагретым воздухом.
Рабочая камера получает пар от парообразователя, помещенного под камерой и соединенного с ней патрубком. Вода в котел поступает через воронку, соединенную с указательной трубкой. Вода в котле нагревается электрическим током от сети. Крышка автоклава имеет внутри электронагревательный элемент с регулятором, посредством которого регулируется нагрев воды. Контроль за давлением производится с помощью манометра. Для автоматического выхода пара при превышении максимального рабочего давления предусмотрен предохранительный клапан. На шкале манометра обозначается только избыточное давление, нормальное же давление соответствует показанию «О». Работа с автоклавом требует строгого выполнения правил, предусмотренных специальной инструкцией, прилагаемой к каждому аппарату.
Инструкцией предусматривается:
1. Перед работой проверить исправность всех частей автоклава.
2. Через воронку налить воду в маленький котел и закрыть кран.
3. Загрузить стерилизационную камеру материалом, подлежащим стерилизации, закрыть крышку.
4. Включить нагревательную систему при открытых паровыпускающих кранах; с появлением пара будет выходить воздух, а затем пар с конденсатом. Кран закрывают, когда воздух из автоклава полностью вытеснен, о чем свидетельствует непрерывная струя пара. При наличии воздуха в автоклаве показания манометра не соответствует температуре.
5. По окончании стерилизации выключают электронагревательный элемент. После того как давление упадет до нуля, открывают спускной кран и приступают к разгрузке автоклава.
При давлении в 0,5 атм температура в автоклаве равна 110-112°С, в 1 атм – 120-121°, в 1,5 атм – 124-126°, в 2 атм – 132-133°С.
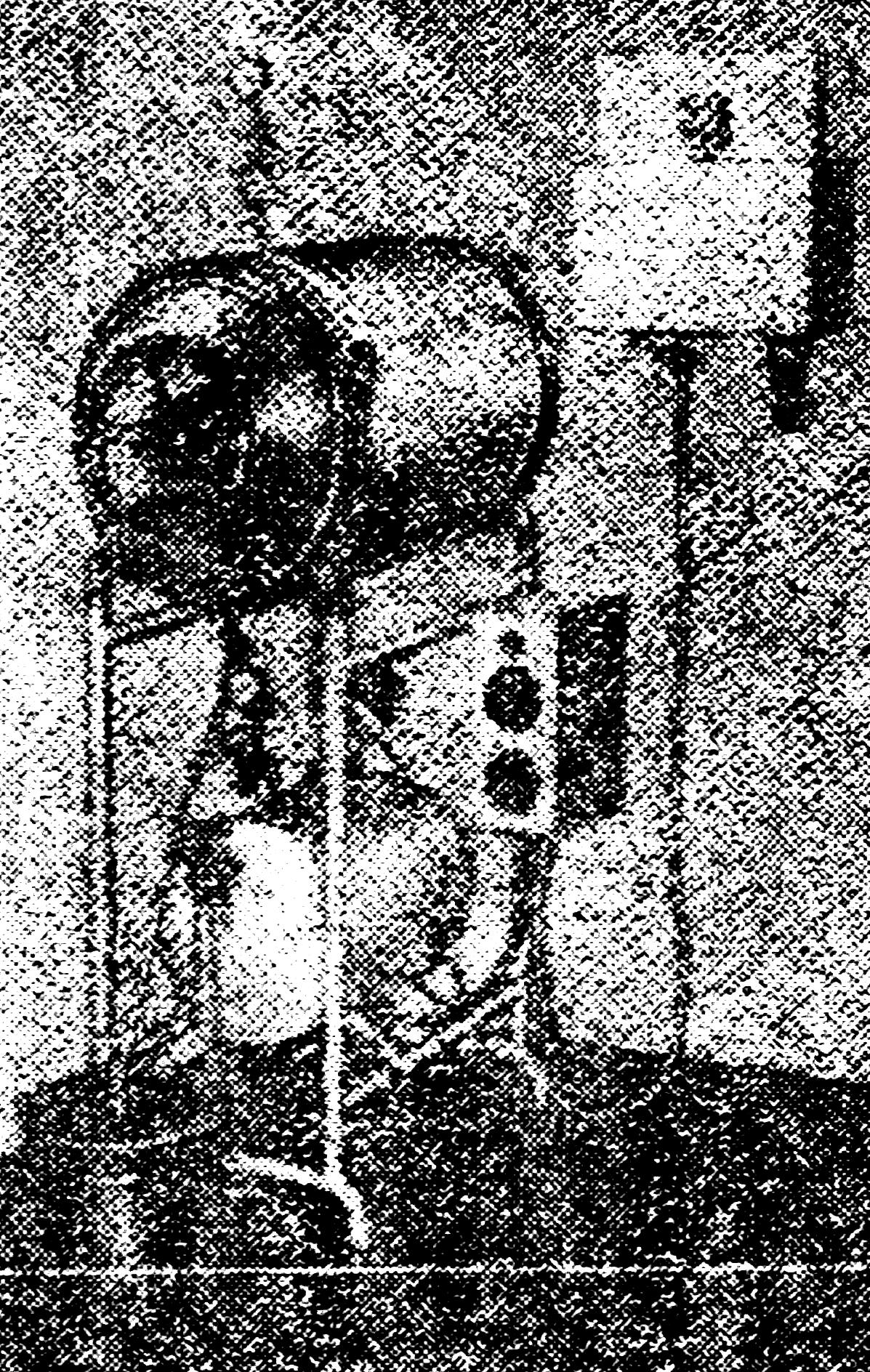
Рис. 18. Автоклав для стерилизации паром под давлением: общий вид
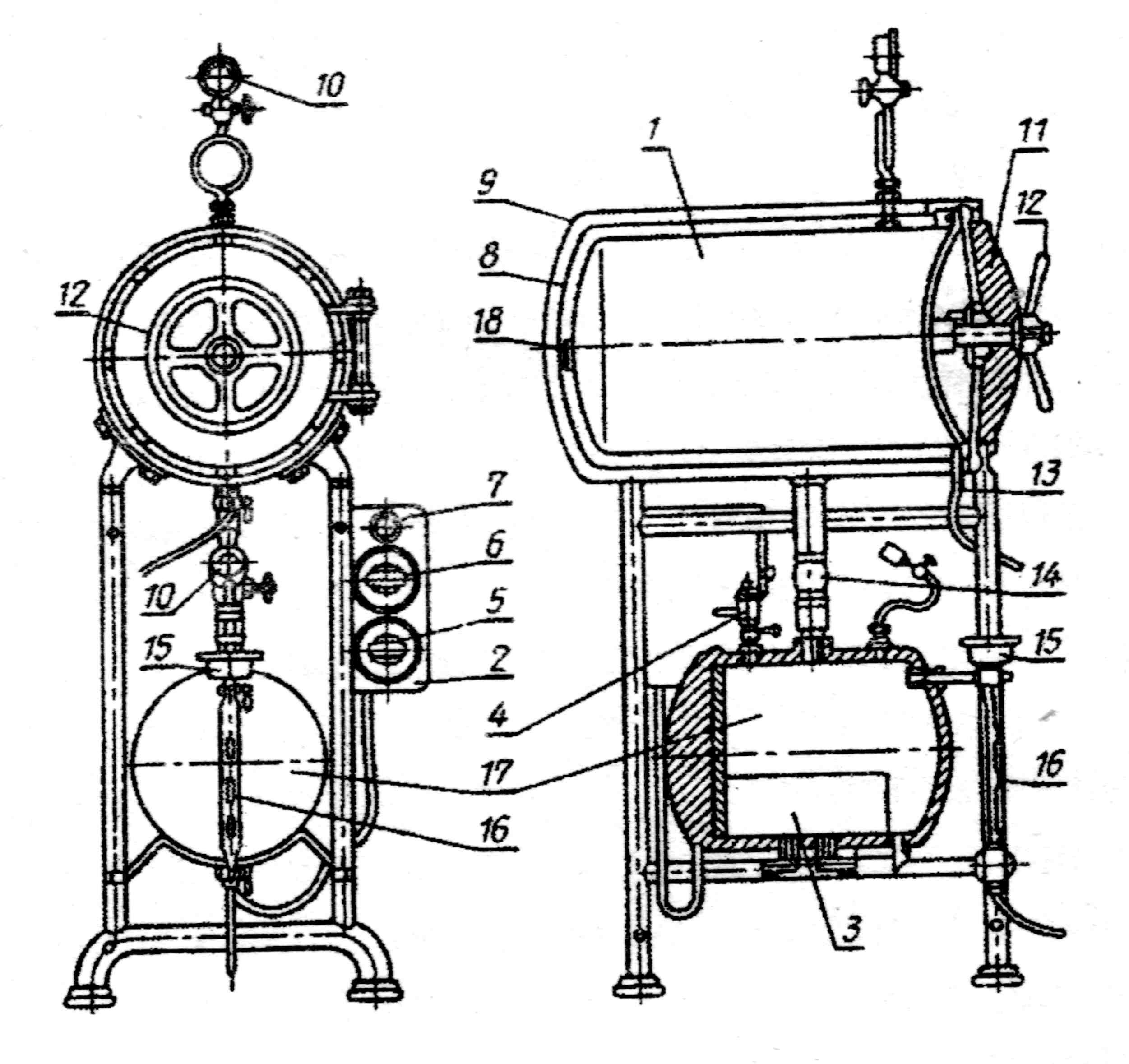
Рис. 19. Схема устройства автоклава: 1 – стерилизационная камера; 2 – электрощит; 3 – нагревательное приспособление; 4 – предохранительный клапан; 5 – переключатель; 6 – выключатель; 7 – сигнальная лампа; 8 – паровая камера; 9 – кожух; 10 – манометр; 11 — крышка; 12 – штурвал; 13 – выпускной кран; 14 – патрубок с вентилем; 15 – воронка; 16 — водомерное стекло; 17 — парообразователь: 18 – отверстие для прохода пара
Для контроля работы автоклава между стерилизуемыми предметами кладут стеклянную запаянную трубку с веществом, имеющим определенную точку плавления (бензонафтол – 110°, бензойная кислота – 120° и др.), и небольшим количеством анилинового красителя. Эффективность стерилизации можно также проверить, помещая в автоклав материал, заведомо зараженный спорами бацилл.
б) Стерилизация текучим паром производится в аппарате Коха, широко применяющемся в лабораторной практике. Аппарат Коха представляет собой металлический цилиндр, покрытый теплоизоляционным материалом. В конической крышке аппарата имеется отверстие для выхода пара. В нижней части расположены кран и водомерная трубка. Внутри имеется подставка для стерилизуемых материалов. На дно аппарата заливается вода, которая не должна касаться стерилизуемого материала. Стерилизуют при 100° в течение 30-60 мин с момента начала кипения воды, при этом вегетативные формы микробов погибают, а споры сохраняются, и при комнатной температуре через сутки прорастают. Повторное воздействие паром снова обезвреживает вегетативные формы. Третье прогревание убивает все остальные бациллы, развивающиеся из спор. Стерилизуют таким методом (дробно) питательные среды и другие материалы, изменяющие свои свойства при температуре выше 100°: молоко, желатину, картофельные среды и среды с углеводами.