ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 24.04.2024
Просмотров: 1160
Скачиваний: 2
СОДЕРЖАНИЕ
Министерство сельского хозяйства
Бактериологическая диагностика
1.2. Техника безопасности при работе в ветеринарной лаборатории
1.3. Общая схема проведения бактериологической диагностики
1.4. Правила взятия, консервирования и транспортировки патологического материала
Сопроводительное письмо на патологический материал
Задания для самостоятельной работы
2.1. Устройство оптического микроскопа.
2.2. Виды микроскопии и их назначение
3.1. Техника приготовления препаратов для микроскопии
3.2. Бактериологические краски
3.3. Простой метод окрашивания препарата для микроскопии
Задания для самостоятельной работы
Вопросы для самоподготовки и контроля знаний
Тема 4. Сложные (дифференциальные) методы окрашивания бактерий (4.1). Окраска по Граму (4.2)
4.1. Сложные (дифференциальные) методы окрашивания бактерий
Задания для самостоятельной работы
Тема 5. Сложные (дифференциальные) методы окрашивания бактерий: окраска спор (5.1) и капсул (5.2)
Тема 6. Назначение и классификация питательных сред для бактерий (6.1) и их приготовление (6.2)
6.1. Назначение и классификация питательных сред
Классификация питательных сред
6. 2. Приготовление питательных сред
Тема 7. Стерилизация. Методы: физические (7.1), химические (7.2), механические (7.3)
8.1. Техника посевов бактерий на питательные среды
8.2. Методы культивирования бактерий
8.3. Методы выделения чистых культур бактерий
Тема 9. Культуральные свойства бактерий на плотных (9.1) и в жидких (9.2) питательных средах
9.1. Культуральные свойства бактерий на плотных питательных средах
9.2. Культуральные свойства бактерий в жидких питательных средах
Тема 10. Ферментативные (биохимические) свойства бактерий
1. Определение ферментации углеводов
2. Определение протеолитических свойств
3. Определение редуцирующей (восстанавливающей) способности
11.1. Методы серийных разведений
Критерии оценки чувствительности стафилококков к пенициллину
11.2. Метод диффузии в агар (метод бумажных дисков)
Тема 12. Исследование бактерий на подвижность
В. Биологические методы исследований
13.1. Методы заражения лабораторных животных
13.2. Определение вирулентности микробов
13.3. Бактериологическое исследование трупа
Тема 14. Культивирование анаэробных микроорганизмов
Тема 15. Методы изучения микроскопических грибов и ак-тиномицетов
Тема 16. Методы изучения риккетсий (16.1), хламидий (16.2) и микоплазм (16.3)
16.1. Методы изучения риккетсий
16.2. Методы изучения хламидий
16.3. Методы изучения микоплазм
Раздел II. Основы санитарной микробиологии
Тема 17. Санитарно-микробиологическое исследование воздуха (17.1) и почвы (17.2)
17.2. Санитарно-микробиологическое исследование почвы
Санитарно-бактериологические показатели почвы
Тема 18. Санитарно-микробиологическое исследование воды
19.1. Методы количественного определения микробов в исследуемых объектах
19.2. Санитарно-микробиологическое исследование мяса
Тема 20. Санитарно-микробиологическое исследование молока (20.1) и кисломолочных продуктов (20.2)
Классификация молока по редуктазе
Показатели бактериальной чистоты питьевого молока
20.2. Санитарно-микробиологическое исследование кисломолочных продуктов
Раздел III. Серологическая диагностика инфекционных болезней сельскохозяйственных животных
21.1. Реакция кольцепреципитации
21.2. Реакция диск-преципитации
21.3. Реакция диффузионной преципитации (рдп)
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
22.2. Другие модификации постановки реакции. Кольцевая реакция с молоком (кр)
Тема 23. Реакция связывания комплемента (рск)
Задания для самостоятельной работы (для трех занятий)
Тема 24. Методы люминесцентной микроскопии
Тема 25. Иммуноферментный метод (ифм) диагностики инфекционных болезней
Тема 26. Использование в микробиологии полимеразной цепной реакции (пцр)
Тема 27. Использование в микробиологии днк-зондов
Раздел IV. Специальная (частная) микробиология
Тема 28. Патогенные стафилококки.
Тема 29. Патогенные стрептококки
Тема 30. Возбудители эшерихиозов
Тема 31. Возбудители сальмонеллезов
Тема 32. Возбудитель листериоза
Тема 33. Возбудитель рожи свиней
Тема 34. Возбудитель антропозоонозной чумы
Тема 35. Возбудители гемофилезов
Тема 36. Возбудитель пастереллеза
Тема 37. Возбудитель туляремии
Тема 38. Возбудитель бруцеллеза
Тема 39. Возбудитель сибирской язвы
40.1. Возбудитель эмфизематозного карбункула (эмкара)
40.2. Возбудители злокачественного отека
40.3. Возбудитель брадзота овец
40.4. Возбудитель инфекционной анаэробной энтеротоксемии
41.3. Возбудитель некробактериоза (фузобактериоза)
41.4. Возбудитель копытной гнили
Тема 42. Возбудители туберкулеза (42.1) и паратуберкулеза (42.2)
42.2. Возбудитель паратуберкулеза
Тема 43. Возбудитель актиномикоза
Тема 45. Возбудитель лептоспироза
Тема 46. Возбудитель кампилобактериоза (вибриоза)
Тема 47. Возбудитель дизентерии свиней
Тема 48. Возбудители микоплазмозов
Тема 49. Возбудители риккетсиозов
Тема 50. Возбудители хламидиозов
Тема 52. Возбудители микотоксикозов
Задания для програмированного контроля знаний студентов по частной ветеринарной микробиологии
Ответы на задания для программированного контроля по разделу «Частная микробиология»
А. Отрицательный.
Б. Сомнительный.
В. Положительный.
Тема 22. Реакция агглютинации: пробирочный метод (22.1). Другие модификации постановки реакции (22.2)
ЦЕЛЬ ЗАНЯТИЯ. Дать представление о сущности реакции агглютинации, применение ее в ветеринарно-лабораторной практике, получении и подготовке компонентов: освоить методы постановки реакции объемным (пробирочным) и капельным методами.
Ознакомить с различными модификациями проведения реакции агглютинации.
МАТЕРИАЛЬНОЕ ОСНАЩЕНИЕ. Пробирки агглютинационные в штативе, пипетки на 1 и 5 мл, резиновые груши, физиологический раствор в колбах, бруцеллезная (позитивная) и нормальная (негативная) сыворотки, единый бруцеллезный антиген для РА и РСК.
Предметные стекла, глазные пипетки, сальмонеллезный антиген и специфически сыворотки.
Для демонстрации: аппарат Флоринского, пробирки с положительной и отрицательной кольцевой реакцией с молоком на бруцеллез; плестиглазовые панели с гемагглютинацией; Роз-бенгаловая проба (РБП) на бруцеллез.
Агглютинацией называется склеивание микробных или других клеток при воздействии на них специфических антител в присутствии электролитов. Двухфазный характер этого взаимодействия ничем не отличается от механизма других двухкомпонентных реакций иммунитета: первая фаза – соединение бактерий с антителом; вторая – соединение бактерий под влиянием солевого раствора. Антиген, вступающий в реакцию, носит название агглютиногена, антитела сыворотки – агглютинины, а комплекс антигена + антитело, выпадающий при положительной реакции – агглютинат.
Реакция агглютинации используется для серологической диагностики многих инфекционных болезней, в том числе бруцеллеза, сальмонеллеза, колибактериоза, сапа, листериоза, кампилобактериоза и др.
Она проводится с двумя целями для:
а) обнаружения специфических антител в исследуемых сыворотках;
б) установления вида (серогруппы, сероварианта) выделенного микроорганизма (антигена) из патологического материала с использованием известных сывороток, содержащих специфические антитела.
Агглютинация происходит при температуре 37°С в слабощелочной солевой среде.
Различают следующие виды по характеру агглютинации:
1. Соматическую, когда происходит склеивание и оседание неподвижных, не имеющих жгутиков, микробов. Эта форма О-агглютинации протекает медленно, в течение 18-24 ч и дает плотный мелкозернистый осадок, который при встряхивании разбивается на мелкие зерна.
2. Жгутиковую, когда происходит склеивание и оседание подвижных, имеющих жгутики, микробов. Эта форма Н-агглютинации происходит значительно быстрее, уже через 2-4 ч, и дает рыхлый осадок, который при встряхивании легко разбивается на крупные хлопья.
Существует много вариантов постановки реакции агглютинации. Наиболее распространенными методами являются: развернутая реакция агглютинации, которая проводится в пробирках с различными разведениями сыворотки; на предметных стеклах (капельная, пластинчатая: кровяно-капельная гемагглютинация; кольцевая проба (реакция) с молоком, Роз-бенгалевая проба (РБП) и др.).
Компонентами для постановки реакции агглютинации с исследуемыми сыворотками являются:
1. Исследуемая сыворотка крови.
Кровь у животных берут из яремной вены (у свиней из ушной или хвостовой, у лисиц и песцов – из бедренной вены, у норок – путем отсечения подушечки среднего пальца задней лапы или кончика хвоста) в стерильные пробирки по 5-7 мл (от пушных зверей по 1-2 мл). Пробирки нумеруют и составляют опись проб.
Сыворотки крови получают методом отстоя. Для свертывания крови и отстаивания сыворотки пробирки с кровью выдерживают 30-60 мин при 20-30°С, сгусток крови от стенок отделяют стальной спицей, а затем пробы выдерживают при +4-10°С. Через 20-24 ч отстоявшуюся сыворотку сливают в сухие стерильные пробирки и направляют на исследование в лабораторию в свежем или консервированном виде.
Сыворотки консервируют:
- добавлением 0,05 мл (1 капля) 5%-ного раствора карболовой кислоты на каждый миллилитр сыворотки при постоянном перемешивании;
- сухой борной кислотой (2-4 % к объему сыворотки) до получения насыщенного раствора и образования на дне пробирки небольшого осадка кристаллов.
Неконсервированные сыворотки пригодны для исследования в течение 6 дней со дня взятия крови с сохранением их при +4-8 °С. Сыворотки, консервированные карболовой или борной кислотой, пригодны для исследования в течение 30 дней. Мутные, проросшие, гемолизированные сыворотки крови исследованию не подлежат.
В зависимости от вида диагностируемой болезни для проведения реакции агглютинации исследуемые сыворотки разводят физиологическим раствором согласно наставлению.
2. Известный антиген представляет из себя взвесь убитых, реже живых бактерий в физиологическом растворе в определенной концентрации. Антигены изготовляют и стандартизируют на биопредприятиях.
3. Физиологический раствор, который представляет из себя 0,85%-ный раствор поваренной соли.
Для контроля РА используют компоненты:
1. Позитивная (положительная) сыворотка, изготовленная биопредприятием или полученная от больного животного.
2. Негативная (отрицательная) – сыворотка крови здоровых животных, изготовленная биопредприятием или полученная в лаборатории.
Компонентами для постановки реакции агглютинации для определения вида микроба с использованием известных специфических сывороток являются:
1. Диагностические агглютинирующие сыворотки, которые получают путем гипериммунизации кроликов, реже – других животных. Им вводят подкожно 5-7 раз, а затем внутривенно в возрастающих количествах взвесь убитых, а последние три инъекции — живых микробов.
Интервалы между инъекциями колеблются от двух до пяти-семи дней. Через неделю после окончания иммунизации производят пробное взятие крови и ставят реакцию агглютинации для определения титра сыворотки. Если титр антител в сыворотке крови недостаточно велик, иммунизацию продолжают. При наличии высокого титра производят массивное взятие крови или полное обескровливание животного с целью получения сыворотки.
Диагностические наборы для проведения реакции агглютинации выпускаются биопредприятиями.
2. Исследуемый антиген, в качестве последнего используют взвесь микробов. Для этого суточную или 20-часовую изучаемую культуру на скошенном МПА смывают 5 мл 0,85%-ного раствора хлористого натрия и переносят в чистую пробирку.
При постановке капельным методом антигеном служит микробная культура.
3. Физиологический раствор поваренной соли.
22.1. Постановка реакции агглютинации классическим (пробирочным) методом
В качестве примера приводим постановку РА на бруцеллез с сывороткой крови крупного рогатого скота.
Реакция ставится в объеме 1 мл жидкости. Разлив компонентов реакции проводят индивидуальными мерными пипетками; автоматическими пипетками Флоринского, одиночными (рис. 63) или групповыми (рис. 64).
Для исследования каждой испытуемой сыворотки крови требуется 5 пробирок, поставленных в первый ряд. Количество таких рядов зависит от числа исследуемых сывороток. В первой пробирке каждого ряда готовят основное разведение 1:25. Для этого к 2,4 мл физиологического раствора вносят 0,1 мл исследуемой сыворотки. После приготовления основного разведения сывороток в остальные 4 пробирки, кроме 2-й, каждого ряда разливают по 0,5 мл физиологического раствора. Затем из первой пробирки из разведения 1:25 вносят 0,5 мл во вторую пробирку, получая разведение 1:50. Из этого разведения готовят разведение 1:100, перенося из одной пробирки 0,5 мл жидкости. Методом последовательного разведения готовят разведение 1:200 и 1: 400. Из последней пробирки (1:400) излишек жидкости 0,5 мл удаляют (рис. 65).
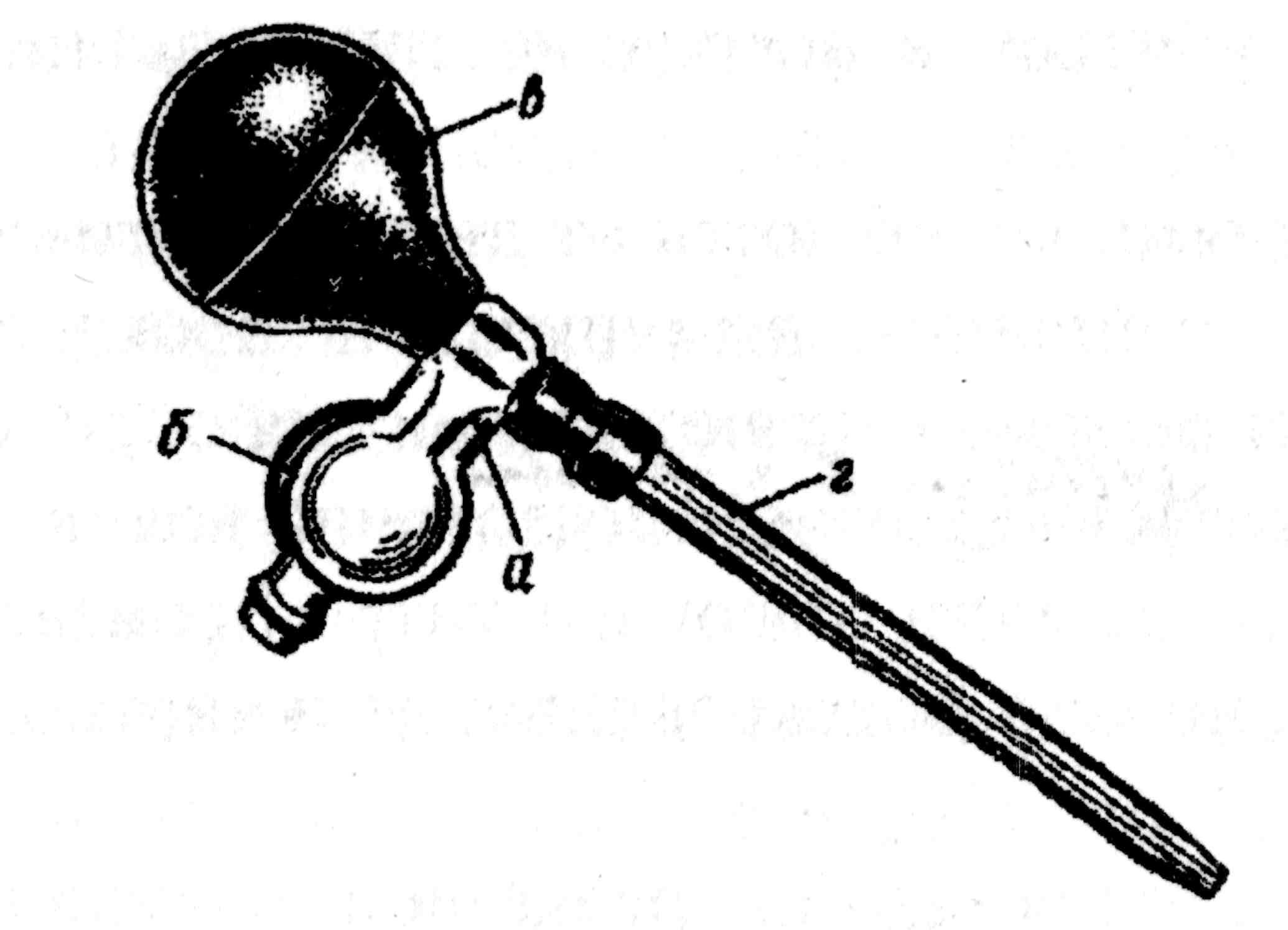
Рис. 63. Одиночная автоматическая пипетка Флоринского: а - стеклянный патрубок; б - расширение для сбора избыточной жидкости; в - резиновая груша; г — пипетка-мерник
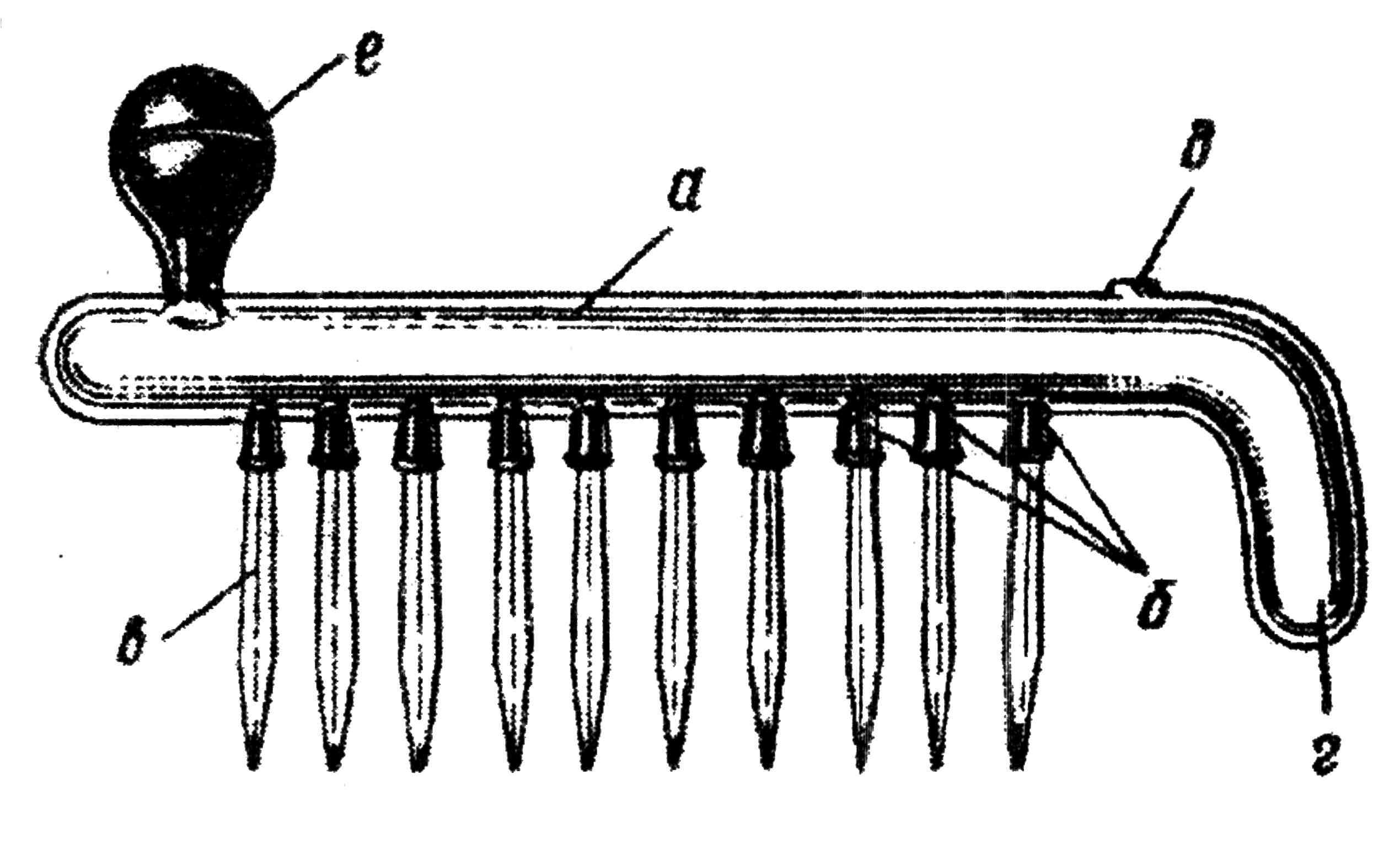
Рис. 64. Групповая автоматическая пипетка Флоринского: а - стеклянный цилиндр; б - отверстие в нижней части цилиндра; в - пипетки-мерники; г - приемник для избыточной жидкости; д — отверстие для слива избыточной жидкости; е -резиновая груша
Во все пробирки, кроме первой, вносят по 0,5 мл антигена, разведенного 1:10
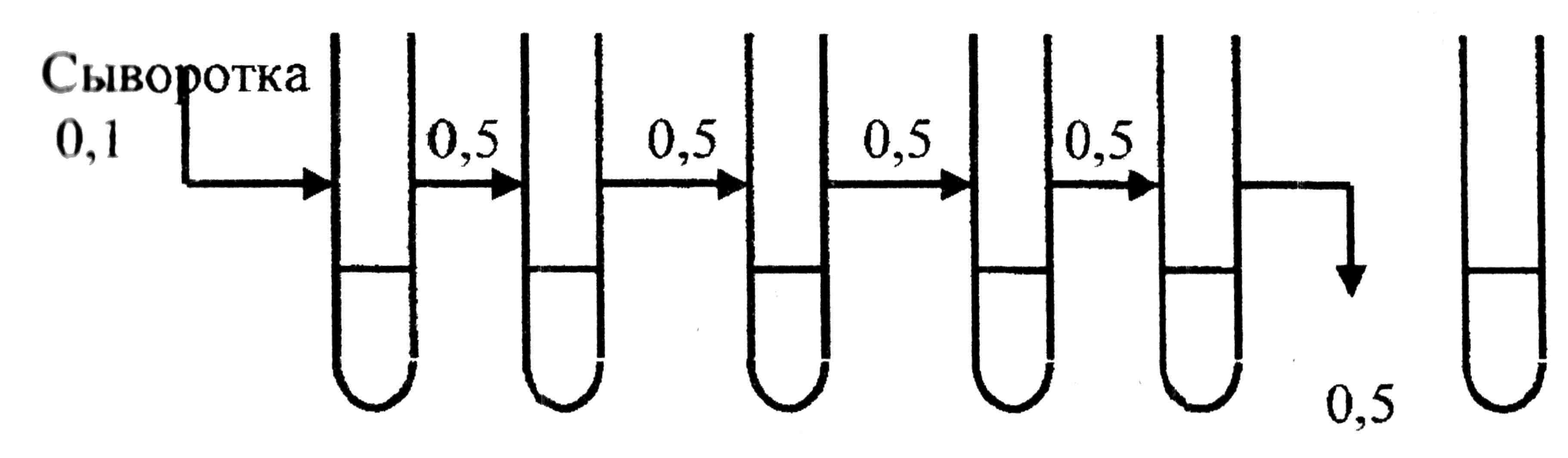
Рис. 65. Схема постановки реакции агглютинации пробирочным методом
Таким образом получают ряд из четырех исследуемых пробирок с разведениями сыворотки 1:50, 1:100, 1:200, 1:400 в объеме 0,5 мл.
Во все пробирки каждого ряда, кроме первой (1:25), вносят по 0,5 мл антигена, предварительно разбавленного 1:10 физиологическим раствором. Первая пробирка с сывороткой в разведении 1:25 без антигена служит контролем качества сыворотки. При наличии хлопьев, фибрина, эритроцитов и посторонних примесей результаты агглютинации не учитываются.